《生物化学》
1.1本章知识点串讲
1、糖类的作用、元素组成、化学本质、命名及分类
作用:能源物质、结构成分、信息分子、转变成其他物质。
元素组成:C、H、O
化学本质:多羟基酮或者多羟基醛
命名及分类:单糖、寡糖和多糖
2、单糖的结构、性质及其衍生物
单糖的结构:链状结构,环状结构等。(一般不作为考点出现)
单糖的性质:
物理性质:旋光性(了解一下),甜度,溶解度。
化学性质:书中共涉及9种化学变化。
1)单糖的氧化:醛糖含有游离的醛基,具有很好的还原性。
被弱氧化剂氧化:醛糖酸。(见教材)
被强氧化剂氧化:醛糖二酸。
2)单糖的还原:还原后生成糖醇。
3)形成糖脎 (见教材)
4)形成糖酯与糖醚、糖苷(见教材)
5)单糖脱水
3、其他糖类(单糖衍生物、寡糖、多糖等)
肽聚糖:(教材P51)青霉素抑菌的作用机理。
1.2本章重难点总结
1、单糖的性质(尤其是化学性质)
2.1本章知识点串讲
天然脂肪酸的结构特点:骨架的碳原子数都是偶数个,这是因为生物体内脂肪酸是以二碳单位(CoA:乙酰形式)从头合成的。
3.1本章知识点串讲
1、氨基酸——蛋白质的构件分子
(1)蛋白质水解:酸水解、碱水解、酶水解(掌握三种具体水解方法及优缺点)(见教材P123)
(2)氨基酸在中性PH时,含有一个正电荷和一个负电荷,称为兼性离子。
2、氨基酸的分类
(1)按照R基的化学机构将20种常见氨基酸分为:脂肪族,芳香族和杂环族三类
A、脂肪族氨基酸:中性氨基酸 含羟基或硫氨基酸 酸性氨基酸及其酰胺 碱性氨基酸
B、芳香族氨基酸 C、杂环族氨基酸
(2)按照R基的极性性质,20种常见氨基酸分为:非极性R基氨基酸、不带电荷的极性R基氨基酸、带正电荷的R基氨基酸、带负电荷的R基氨基酸。
3、氨基酸的酸碱化学
氨基酸的兼性离子形式(见教材P130)
氨基酸的解离:氨基酸是一类两性电解质
氨基酸的解离常数(重点)
(3)氨基酸的等电点:某一氨基酸处于静电荷为0时的pH。(pI)
对于侧链不解离的中性氨基酸:pI=1/2(pKa1+ pKa2 )
(4)氨基酸的甲醛滴定 甲醛的作用(重点)
4、氨基酸的化学反应
(1)a-氨基参加的反应(4类)(见教材P135)
(2)a-羧基参加的反应(4类)(见教材P138)
(3)a-氨基和a-羧基共同参加的反应(2类)(见教材P139)
(4)侧链R基参加的反应
蛋白质的化学修饰:在较温和的条件下,以可控制的方式使蛋白质与某种试剂(称化学修饰剂)起特异反应,以引起蛋白质中个别氨基酸侧链或功能团发生共价化学改变。
5、氨基酸的光学活性和光谱性质
蛋白质的最大紫外吸收在280nm波长处
核磁共振(NMR)是一项涉及在外磁场存在下某些原子核吸收射频能量的波谱技术。
6、氨基酸混合物的分析分离(见教材P148)
(1)分配层析法的一般原理(2)分配柱层析(3)纸层析(4)薄层层析(5)离子交换层析
(6)气液层析(7)高效液相层析(HPLC)
3.2本章重难点总结
(1)氨基酸的书写,氨基酸的分类及氨基酸的化学性质。
(2)氨基酸的分离
4.1本章知识点串讲
1、蛋白质通论
(1)蛋白质的化学组成和分类
蛋白质的平均含氮量为16%,凯氏定氮法测定蛋白质含量:
蛋白质含量=蛋白氮*6.25
(2)名词:单纯蛋白,缀合蛋白
(3)蛋白质结构的组织层次:
一级结构:多肽链的氨基酸序列
二级结构:多肽链借助氢键排列成自己特有的a螺旋和B折叠股片段。
三级结构:多肽链借助各种非共价键(非共价力)弯曲、折叠成具有特定走向的紧密球状构象。
四级结构:寡聚蛋白质中各亚基之间在空间上的相互关系和结合方式。
(4)蛋白质功能具有多样性
2、肽
(1)肽和肽键的结构 茚三酮、双缩脲反应(见教材P166)
3、蛋白质一级结构的测定
(1)蛋白质测序的策略(测定蛋白质的一级结构,要求样品必须是均一的,纯度应在97%以上)
(见教材P168)
(2)N-末端和C-末端氨基酸残基的鉴定
A、N-末端分析(见教材P169)
a 二硝基氟苯法(DNFB)
b 丹磺酰氯法(DNS)
c 苯异硫氰酸酯法(PITC)
d 氨肽酶法
B、C-末端分析(见教材P170)
a 肼解法
b 还原法
c 羧肽酶法(目前常见的4种羧肽酶:A、B、C、Y)
(3)二硫桥的断裂
(4)氨基酸组成的分析
(5)多肽链的部分裂解和肽段混合物的分离纯化
A 酶裂解法
B 化学裂解法
(6)肽段氨基酸序列的测定
A Edman化学降解法
B 酶降解法
C 质谱法
D 根据核苷酸序列的推定法
(7)肽段在多肽链中次序的决定
(8)二硫桥位置的确定
4.2本章重难点总结
1、蛋白质结构的组织层次2、蛋白质一级结构的测定
5.1本章知识点串讲
1、研究蛋白质构象的方法:NMR
2、稳定蛋白质三维结构的作用力
稳定蛋白质三维结构的作用力主要是一些所谓弱的相互作用或称非共价键或次级键,包括氢键、范德华力、疏水作用和盐键(离子键)。
(1)氢键:稳定蛋白质二级结构的主要作用力
(2)范德华力(范德华相互作用):定向、诱导和分散。
(3)疏水作用(熵效应)
水介质中球状蛋白质的折叠总是倾向于把疏水残基埋藏在分子的内部,这一现象为疏水作用或疏水效应。
(4)盐键
(5)二硫键
3、二级结构:多肽链折叠的规则方式
在能量平衡中,蛋白质主链的折叠产生由氢键维系的有规则的构象,称为二级结构。常见的二级结构元件:a螺旋,B折叠片,B转角和无规卷曲等。(见教材p207)
4、超二级结构和结构域
(1)超二级结构
A 在蛋白质分子中特别是在球状蛋白质分子中经常可以看到由若干相邻的二级结构元件(主要是a螺旋和B折叠片)组合在一起,彼此相互作用,形成种类不多的、有规则的二级结构组合或二级结构串,在多蛋白质中充当三级结构的构件,称为超二级结构。
B超二级结构的基本组合形式:aa、BaB、BB (见教材p222)
(2)结构域
A 概念:多肽链在二级结构或超二级结构的基础上形成三级结构的局部折叠区,它是相对独立的紧密球状实体,成为结构域。
B 类型:(见教材p223)
5、球状蛋白质与三级结构
(1)球状蛋白质的分类(简单了解见教材224)
(2)球状蛋白质的三维结构特征(简单了解 见教材228)
(3)三级结构是指由二级结构元件构建成的总三维结构,包括一级结构中相距远的肽段之间的几何相互关系和侧链在三维空间中彼此间的相互关系。
6、蛋白质折叠和结构预测
(1)蛋白质变性
A 概念:天然蛋白质分子受到某些物理因素如热、紫外线照射、高压和表面张力等或化学因素如有机溶剂、酸、碱等的影响时,生物活性丧失,溶解度降低,不对称性增高以及其他的物理化学常数发生改变,这种过程称为蛋白质变性。
B 变性的实质:蛋白质分子中的次级键被破坏,引起天然构象解体。(变形不涉及共价键的破裂,一级结构仍然完好。)
C 变性过程中发生的现象:生物活性丧失;一些侧链基团暴露;一些物理化学性质改变;生物化学性质改变。
D 变性剂:尿素和盐酸胍,能与多肽主链竞争氢键,因此破坏蛋白质的二级结构。
十二烷基磺酸钠(SDS)也是去污剂。
E 蛋白质复性:当变性因素除去后,变性蛋白质又可重新回复到天然构象,这一现象称为蛋白质复性。
(2)蛋白质结构的预测
蛋白质的三维机构是由一级序列决定的。
7、亚基缔合和四级结构
(1)有关概念:
球状蛋白质通过非共价键彼此缔合在一起,缔合形成聚集体的方式构成蛋白质的四级结构。
四级结构的蛋白质中每个球状蛋白质称为亚基。亚基一般是一条多肽链。亚基也称为单体。
由两个亚基组成的称为二聚体蛋白。由4个亚基组成的称为四聚体蛋白。
(2)四级缔合的驱动力
稳定四级结构的作用力与稳定三级结构的作用力相同,为:范德华力、氢键、离子键和疏水作用。
(3)四级缔合在结构和功能上的优越性 A 增强结构稳定性 B 提高遗传经济性和效率
C 使催化基团汇集在一起 D 具有协同性和别构效应
(4)概念
多亚基蛋白质一般具有多个结合部位,结合在蛋白质分子的特定部位上的配体对该分子的其他部位所产生的影响称为别构效应。别构效应分为同促效应和异促效应。
同促效应发生作用的部位是相同的,也即一种配体的结合对在其他同种部位的同种配体的亲和力影响,这种影响一般是使亲和力加强。
异促效应发生作用的部位是不同的,也即活性部位的结合行为将受到别构部位与效应物结合的影响。
5.2本章重难点总结
蛋白质结构层次的相关概念。
6.1本章知识点串讲
1、肌红蛋白的结构与功能(了解)
2、血红蛋白的结构与功能
(1)血红蛋白的主要功能就是在血液中结合并转运氧气。
(2)Bohr效应的重要生理意义。(p264)
当血流经组织特别是流经代谢迅速的肌肉时由于这里的PH较低,CO2浓度较高,因此有利于血红蛋白释放氧气,使组织比单纯的氧分压降低获得更多的氧,而氧的释放又促使血红蛋白与H+和CO2的结合,以补偿由于组织呼吸形成的CO2所引起的PH降低,起着缓冲血液PH的作用。当血液流经肺部时,由于肺部氧分压较高,有利于血红蛋白与氧结合并因此促进了H+和CO2的释放,同时CO2的呼出又有利于氧合血红蛋白的生成。
7.1本章知识点串讲
1、蛋白质的酸碱性质
蛋白质是两性电解质。在没有其他盐类干扰时,蛋白质质子供体基团解离出来的质子数与质子受体基团结合的质子数相等时的pH称为等离子点。
2、蛋白质的分子大小与形状(见教材 291)
(1)根据化学组成测定最低相对分子质量
(2)沉降分析法测定相对分子质量:利用超速离心机。
(3)凝胶过滤法测定相对分子质量
(4)SDS聚丙烯酰胺凝胶电泳法测定相对分子质量
蛋白质颗粒在各种介质包括聚丙烯酰胺凝胶中电泳时,它的迁移率决定于它所带的净电荷以及分子大小和形状等因素。如果在聚丙烯酰胺凝胶系统中加入阴离子去污剂SDS和少量巯基乙醇,蛋白质分子的电泳迁移率主要取决于它的相对分子质量,而与原来所带的电荷和分子形状无关。
3、蛋白质的胶体性质与蛋白质的沉淀
(1)蛋白质的胶体性质:蛋白质溶液属于胶体系统。
(2)蛋白质的沉淀:蛋白质在溶液中的稳定是相对的,有条件的。沉淀蛋白质的方法有以下几种:(见教材p300)
A 盐析法:一般不引起蛋白质变性
B 有机溶剂沉淀法
C 重金属盐沉淀法
D 生物碱试剂和某些酸类沉淀法
E 加热变性沉淀法
4、蛋白质分离纯化的一般原则
蛋白质纯化的总目标是增加制品的纯度或比活,以增加单位蛋白质重量中所要蛋白质的含量或生物活性。
分离纯化蛋白质的一般程序:前处理、粗分级处理、细分级处理。
5、蛋白质的分离纯化方法(见教材 p301)
(1)根据分子大小不同的纯化方法
A 透析和过滤
透析是利用蛋白质分子不能透过半透膜的性质,使蛋白质和其他小分子物质如无机盐、单糖等分开。
过滤或超滤:利用压力或离心力,强行使水和其他小分子溶质通过半透膜,而蛋白质被截留在膜上,以达到浓缩和脱盐的目的。
B 密度梯度(区带)离心
蛋白质在具有密度梯度的介质中离心时,质量和密度大的颗粒沉降得快。
C 凝胶过滤:根据分子大小分离蛋白质
(2)利用溶解度差别的纯化方法
影响蛋白质溶解度的外部因素:溶液的PH,离子强度,介电常数,温度
A 等电点沉淀和PH控制
蛋白质处于等电点时,其净电荷为0,由于相邻蛋白质分子之间没有静电斥力而趋于聚集沉淀,因此在其他条件相同时,它的溶解度达到最低点。
B 蛋白质的盐溶和盐析
中性盐可以增加蛋白质的溶解度,这种现象称为盐溶。
当溶液的离子强度达到一定数值时,蛋白质溶解度开始下降,并从水中沉淀出来,这种现象称为盐析。
C 有机溶剂分级分离法
D 温度对蛋白质溶解度的影响
(3)根据电荷不同的纯化方法
A 电泳:在外电场的作用下,带点颗粒将向着与其电性相反的电极移动
B 聚丙烯酰胺凝胶电泳(PAGE)
C 毛细管电泳
D 等电聚焦(IEF)
E 层析聚焦
F 离子交换层析
(4)利用选择性吸附的纯化方法
(5)利用对配体的特异生物学亲和力的纯化方法
(6)高效液相层析和快速蛋白质液相层析
6、蛋白质的含量测定与纯度鉴定
(1)蛋白质含量测定 凯氏定氮法,双缩脲法等。
(2)蛋白质纯度的鉴定
7.2本章重难点总结
蛋白质分离纯化的方法
(这一部分内容和实验本身紧密相关,是考试的重中之重)
8.1本章知识点串讲
1、酶催化作用的特点
酶作为生物催化剂的特点:
A 酶易失活 B 酶具有很高的催化效率 C 酶具有高度专一性 D 酶活性受到调节和控制(具体调节方式见教材 p322)
2、酶的化学本质及组成
(1)酶的化学本质:有催化活性的RNA和蛋白质
不能说所有的蛋白质都是酶,只有具有催化作用的蛋白质,才称为酶。
(2)酶的化学组成
从化学组成来看,酶分为单纯蛋白质和缀合蛋白质。
属于缀合蛋白质的酶类,除了蛋白质外,还要结合一些对热稳定的非蛋白质小分子物质或金属离子,前者称为脱辅酶,后者称为辅因子。全酶=脱辅酶+辅因子。
酶的辅因子,包括金属及有机化合物,根据他们与脱辅酶结合的松紧程度不同,可分为两类,辅酶和辅基。
辅酶指与脱辅酶结合比较松弛的小分子有机物,通过透析方法可以除去,如辅酶I和辅酶II等。
辅基是以共价键和脱辅酶结合,不能通过透析除去,需要经过一定的化学处理才能与蛋白质分开,如FAD等。
注意事项见教材(p324)
3 酶的命名和分类(简单了解)
4 酶的专一性
(1)酶的专一性:结构专一性和立体异构专一性
(2)关于酶作用专一性的假说
诱导契合假说:当酶分子与底物分子接近时,酶蛋白受底物分子诱导,其构象发生有利于底物结合的变化,酶与底物在此基础上互补契合进行反应。
5、酶的活力测定和分离纯化
(1)酶活力的测定
A 酶活力:酶催化某一化学反应的能力,酶活力的大小可以用在一定条件下所催化的某一化学反应的反应速率来表示,两者呈线性关系。
B 酶的活力单位(U)(见教材p336)
酶活力的大小即酶含量的多少,用酶活力单位表示,即酶单位(U)。
酶单位:在一定条件下,一定时间内将一定量的底物转化为产物所需的酶量。(U/g,U/ml)
1961年,国际单位IU,1IU=1umol/min
1976年,国际单位Kat 1Kat=1mol/s
C 酶的比活力 :每mg蛋白质所含的酶活力单位数,对于同一种酶来说,比活力越大表示酶的纯度越高。
比活力=活力U/mg蛋白=总活力U/总蛋白mg
D 酶活力的测定方法(见教材p336)
(2)酶的分离和纯化
生物细胞产生的酶有两类:胞外酶、胞内酶
胞外酶比胞内酶更容易分离纯化。
根据酶的特点在分离纯化中应注意一下几点:(见教材 p338)
选材、破碎、抽提、分离及纯化、结晶、保存
6、核酶(简单了解)
RNase P是催化tRNA前体5’端成熟的内切核酸酶,是由RNA和蛋白质两部分组成。
7、抗体酶(简单了解)
抗体酶是一种具有催化能力的蛋白质,其本质上是免疫球蛋白
8、酶工程简介(简单了解)
固定化酶:将水溶性酶用物理或化学方法处理,使之成为不溶于水的,但仍具有酶活性的状态。
生物酶工程:是酶学和以DNA重组技术为主的现代分子生物学技术相结合的产物。
8.2本章重难点总结
酶的化学组成及酶活力单位。
9.1本章知识点串讲
1、化学动力学基础
(1)反应速率及其测定
瞬时反应速率
(2)反应分子数和反应级数
A 反应分子数:在反应中真正相互作用的分子数
B 反应级数:根据实验结果,整个化学反应的速率服从哪种分子反应速率方程式,则这个反应即为几级反应。
反应级数表示反应速率与反应物浓度之间关系的问题。
2、底物浓度对酶反应速率的影响
(1)中间络合物学说
内容:当底物浓度较低时,反应速率与底物浓度的关系呈正比关系,表现为一级反应,随着底物浓度的增加,反应速率不再按比例升高,反应表现为混合级反应。当底物浓度达到相当高时,底物浓度对反应速率影响变小,最后反应速率与底物浓度几乎无关,反应达到最大速率(Vmax),表现为零级反应。酶底物中间络合物学说认为当酶催化某一化学反应时,酶首先和底物结合生成中间复合物(ES),然后生成产物P,并释放出酶。
S+E==ES==P+E
(2) 酶促反应的动力学方程式
A 米氏方程式的推导(见教材p356)
v=Vmax[S]/(Km+[S])
这个方程称为Michaelis-Menten方程,是在假定存在一个稳态反应条件下推导出来的,其中 Km 值称为米氏常数,Vmax是酶被底物饱和时的反应速度,[S]为底物浓度。由此可见Km值的物理意义为反应达到1/2Vmax的底物浓度,单位一般为mol/L,只由酶的性质决定,而与酶的浓度无关。可用Km的值鉴别不同的酶。当底物浓度非常大时,反应速度接近于一个恒定值。
B 米氏常数和Vmax的意义
Km是酶的一个特性常数,Km的大小只与酶的性质有关,而与酶的浓度无关。Km值随测定的底物、反应的温度、PH及离子强度而改变。
①当ν=Vmax/2时,Km=[S]。因此,Km等于酶促反应速度达最大值一半时的底物浓度。
②当k-1>>k+2时,Km=k-1/k+1=Ks。因此,Km可以反映酶与底物亲和力的大小,即Km值越小,则酶与底物的亲和力越大;反之,则越小。
③Km可用于判断反应级数:当[S]<0.01Km时,ν=(Vmax/Km)[S],反应为一级反应,即反应速度与底物浓度成正比;当[S]>100Km时,ν=Vmax,反应为零级反应,即反应速度与底物浓度无关;当0.01Km<[S]<100Km时,反应处于零级反应和一级反应之间,为混合级反应。
④Km是酶的特征性常数:在一定条件下,某种酶的Km值是恒定的,因而可以通过测定不同酶(特别是一组同工酶)的Km值,来判断是否为不同的酶。
⑤Km可用来判断酶的最适底物:当酶有几种不同的底物存在时,Km值最小者,为该酶的最适底物。
⑥Km可用来确定酶活性测定时所需的底物浓度:当[S]=10Km时,ν=91%Vmax,为最合适的测定酶活性所需的底物浓度
⑦Vmax可用于酶的转换数的计算:当酶的总浓度和最大速度已知时,可计算出酶的转换数,即单位时间内每个酶分子催化底物转变为产物的分子数。
3、 酶的抑制作用
(1)概念:由于酶的必需基团化学性质的改变,但酶未变性,而引起酶活力的降低或丧失而称为抑制作用。
(2)抑制作用的类型
A 不可逆的抑制作用:抑制剂与酶的必需基团以共价键结合而引起酶活力丧失,不能用透析、超滤等物理方法除去抑制剂而使酶复活,称为不可逆抑制。
B 可逆的抑制作用:抑制剂与酶以非共价键结合而引起酶活力降低或丧失,能用物理方法除去抑制剂而使酶复活,这种抑制作用是可逆的称为可逆抑制。
根据可逆抑制剂与底物的关系,可逆抑制分为三种类型:竞争性抑制、
非竞争性抑制、反竞争性抑制
(3)可逆抑制作用动力学(了解 见教材 p370)
(4)一些重要的抑制剂(了解 见教材 p373)
4、影响酶反应的因素(见教材 p378)
温度 PH 激活剂
9.2本章重难点总结
1 、米氏方程的推导及应用
2 、酶的抑制作用类型
10.1本章知识点串讲
1、酶的活性部位
(1)酶活性部位的特点
某些特异氨基酸集中的区域,即与酶活力直接相关的区域称为活性部位或活性中心。
活性部位分为:结合部位和催化部位。前者负责与底物结合,决定酶的专一性,后者负责催化底物键的断裂形成新键,决定酶的催化能力。辅酶分子或辅酶分子上的某一部分结构,往往也是酶活性部位组成部分。
A 活性部位在酶分子的总体中只占相当小的部分
B 酶的活性部位是一个三维实体
C 诱导契合(重点)
D 酶的活性部位是位于酶分子表面的一个裂缝内。
E 底物通过次级键较弱的力结合到酶上。
F 酶活性部位具有柔性或可运动性。
诱导契合(induced-fit):酶的活性部位并不是和底物的形状正好互补的,而是在酶和底物的结合过程中,底物分子或酶分子,有时是两者的构象同时发生了一定的变化后才互补的,这时催化基团的位置也正好在所催化底物键的断裂和即将生成键的合适位置。这个动态的辨认过程称为诱导契合。
(2)研究酶活性部位的方法
A 侧链基团的化学修饰法
非特异性共价修饰
特异性共价修饰
亲和标记法
B 其他方法(简要了解 见教材p386)
2、酶催化反应的独特性质(见教材 p388)
3、影响酶催化效率的有关因素
(1)底物和酶的邻近效应和定向效应
A 邻近效应:酶与底物形成中间复合物以后,使底物和底物之间,酶的催化基团与底物之间结合于同一分子而使有效浓度得以极大的提高,从而使反应速率大大增加的一种效应。
B定向效应是指反应物的反应基团之间和酶的催化基团与底物的反应基团之间的正确取位产生的效应。
(2)底物的形变和诱导契合
(3)酸碱催化
通过瞬时的向反应物提供质子或从反应物接受质子以稳定过渡态,加速反应的一类催化机制。
(4)共价催化 又称亲核催化,或亲电子催化,在催化时,亲核催化剂或亲电子催化剂能分别放出电子或汲取电子并作用于底物的缺电子中心或负电子中心,迅速形成不稳定的共价中间复合物,降低反应活化能,使反应加速。
(5)金属离子催化
(6)多元催化和协同效应
(7)活性部位微环境的影响
4、酶催化反应机制的实例(见教材 p394)
5、酶活性的调节控制
(1)别构调控(allosteric regulation)
酶分子的非催化部位与某些化合物可逆地非共价结合后发生构象的改变,进而改变酶活性状态,称为别构调控。具有这种调节作用的酶称为别构酶。凡能使酶分子发生别构作用的物质称为效应物或别构剂,通常为小分子代谢物或辅因子。
导致酶活性增加的物质称为正效应物或别构激活剂,反之为负效应物或别构抑制剂。
别构酶的性质:一般都是寡聚酶,通过次级键由多亚基构成。
(2)酶原的激活:由无活性状态转变成活性状态是不可逆的
(3)可逆的共价修饰:通过共价调节酶进行
6、同工酶
概念:催化相同的化学反应,但其蛋白质分子结构、理化性质和免疫能力等方面都存在明显差异的一组酶。
10.2本章重难点总结
1、酶活性部位的特点
2、影响酶催化效率的有关因素
11.1本章知识点串讲
1、维生素概论
(1)已知绝大多数维生素作为酶的辅酶或辅基的组成成分。
(2)维生素的分类
根据溶解性质分为:脂溶性和水溶性
脂溶性:维生素A、D、E、K等。
水溶性:维生素B1、B2、烟酸和烟酰胺、B6、泛酸、生物素、叶酸、B12和维生素C等。
2、水溶性维生素
(1)维生素PP和烟酰胺辅酶
维生素PP包括烟酸和烟酰胺。
在体内烟酰胺与核糖、磷酸、腺嘌呤组成脱氢酶的辅酶,只要是烟酰胺腺嘌呤二核苷酸(NAD+,辅酶I)和烟酰胺腺嘌呤二核苷磷酸(NADP+,辅酶II),其还原形式为NADH、NADPH。
(2)维生素B2和黄素辅酶
维生素B2又名核黄素。在体内核黄素是以黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)形式存在,是生物体内一些氧化还原酶(黄素蛋白)的辅基,与蛋白部分结合很牢。
(3)泛酸和辅酶A
泛酸是辅酶A和磷酸泛酰巯基乙胺的组成成分,辅酶A是泛酸的主要活性形式,简写为CoA
(4)维生素B6:包括吡哆醇、吡哆醛、吡哆胺。
11.2本章重难点总结
了解维生素及辅酶的相关概念
12.1本章知识点串讲
1、核酸的种类和分布
(1)脱氧核糖核酸(DNA)
A 分布:原核细胞DNA集中在核区,真核细胞DNA分布在核内,线粒体,叶绿体等细胞器也含有DNA。病毒有且只有DNA或RNA。
B 原核生物染色体DNA、质粒DNA、真核生物细胞器DNA:环状双链
真核生物DNA:线性
质粒:染色体外基因,它们能够自主复制,并给出附加的性状。
(2)核糖核酸(RNA)
A 分类:tRNA、mRNA 、rRNA
原核生物信使RNA结构简单,由于功能相近的基因组成操纵子作为一个转录单位,产生多顺反子mRNA。真核生物信使RNA结构复杂,有5’端帽子和3’poly(A)尾巴,以及非翻译区调控序列,但功能相关的基因不形成操纵子,不产生多顺反子mRNA。
2、核酸的生物功能
(1)DNA是主要的遗传物质
(2)RNA参与蛋白质的生物合成
(3)RNA功能具有多样性
12.2本章重难点总结
核酸的分类及功能
13.1本章知识点串讲
核酸的基本组成单位是核苷酸,核苷酸由一分子磷酸,一分子五碳糖和一分子含氮碱基组成。五碳糖和含氮碱基合称为核苷。
1、核苷酸
(1)碱基
A 嘧啶碱 (C、T、U)
B 嘌呤碱(A、G)
C 稀有碱基:大部分都是甲基化碱基
(2)核苷
核苷是一种糖苷,由戊糖和碱基缩合而成。糖与碱基之间以糖苷键相连。糖与碱基之间的连键是N-C键,一般称之为N-糖苷键。
假尿嘧啶核苷的结构很特殊,C-糖苷键。
(3)核苷酸 (共8种)
2、核酸的共价结构 (核酸的一级结构,通常指核酸的核苷酸序列)
(1)核酸中核苷酸的连接方式:磷酸二酯键
(2)DNA的一级结构:
A 由4中脱氧核苷酸通过3’、5’磷酸二酯键连接起来的直线形或环形多聚体。
B 真核生物与原核生物基因的比较
原核的基因是连续的,无内含子,功能相关的基因组成操纵子,有共同的调节和控制序列,调控序列所占比例较小,很少重复序列。
真核生物的基因是断裂的,有内含子,功能相关基因不组成操作子,调控序列所占比例大,有大量重复序列。
(3)RNA的一级结构
原核生物以操纵子作为转录单位,产生多顺反子mRNA,即一条mRNA链上有多个编码区,5’端和3’端各有一段非翻译区。
真核生物mRNA都是単顺反子,5’端有帽子结构,然后依次是5’非编码区,编码区,3’非编码区和3’端poly(A)尾巴。其分子内有时还有极少甲基化的碱基。(见教材p484)
poly(A)尾巴的作用:与mRNA从细胞核到细胞质的运输有关。
5’端帽子是一个特殊结构,帽子结构通常有三种类型。分别为:O型、I型和II型。
O型:
I型:
II型:
(三种类型的含义及书写是重点,见教材p484)
3、DNA的高级结构
(1)DNA碱基组成的Chargaff规则: A=T C=G A+C=G+T A+G=C+T
(2)DNA的二级结构(DNA分子的双螺旋结构模型)
A 两条反向平行的多核苷酸链围绕同一中心轴相互缠绕,两条链均为右手螺旋。
B 嘌呤与嘧啶碱位于双螺旋的内侧,磷酸与核糖在外侧,彼此通过3’,5’-l磷酸二酯键相连接,形成DNA分子的骨架。
C 双螺旋的平均直径为2nm,两个相邻的碱基对之间相距的高度,即碱基堆积距离为0.34nm,两个核苷酸之间的夹角为36°。
D 两条核苷酸链依靠彼此碱基之间形成的氢键相连系而结合在一起。
F 碱基在一条链上的排列顺序不受任何限制。
(3)DNA能以多种不同的构象存在:B型、A型、C型、D型、E型和左手螺旋的Z型。A型和B型是DNA的两种基本构象,Z型则比较特殊。
比较A型和B型DNA的差异性。(见教材p488)
(4)DNA的三级结构
A 概念:DNA分子通过通过扭曲和折叠所形成的特定构象,包括不同二级结构单元间的相互作用、单链与二级结构单元间的相互作用以及DNA的拓扑特征。超螺旋是DNA三级结构的一种形式。
B DNA的一些重要拓扑学特性(见教材p491) 连环数 扭转数 超螺旋数 比连环差
(5)DNA与蛋白质复合物的结构
A 病毒颗粒由核酸和蛋白质组成
B 真核生物的染色体
在分裂间期,基因组以染色质形式存在。染色质分为常染色质和异染色质。(概念见教材p493)
染色质的基本组成单位是核小体
核小体由组蛋白核心和盘绕其上的DNA所构成。核心由组蛋白H2A、H2B、H3和H4各两分子组成,是一个八聚体,DNA以左手螺旋在组蛋白核心上盘绕1.8圈,共146bp。
C 真核生物染色体DNA组装的过程(重点 见教材495)
4 RNA的高级结构
(1)tRNA的高级结构
tRNA的二级结构都呈三叶草形。三叶草形结构由氨基酸臂、二氢尿嘧啶环、反密码环、额外环和T∮C环等5个部分组成。(见教材 p496)
氨基酸臂:由7对碱基组成,富含鸟嘌呤,末端为CCA,接受活化的氨基酸。
二氢尿嘧啶环:由8-12个核苷酸组成,具有两个二氢尿嘧啶。
反密码环:由7个核苷酸组成、环中部为反密码子。
额外环:由3-18个核苷酸组成。
T∮C环(假尿嘧啶核苷-胸腺嘧啶核糖核苷环):由7个核苷酸组成。
(2)rRNA的高级结构(了解 见教材p498)
13.2本章重难点总结
13.2.1重难点知识点总结
1、两种核酸的结构
2、相关概念
13.2.2本章重难点例题讲解
【例题1】简要叙述真核生物染色体DNA组装的过程。
解析:
14.1本章知识点串讲
1、核酸的水解
(1)酸水解
糖苷键和磷酸酯键都能被酸水解
(2)碱水解
RNA的磷酸酯键易被碱水解,产生核苷酸。DNA的磷酸酯键则不易被碱水解。
(3)酶水解(了解 见教材p503)
2、核酸的酸碱性质 (了解 见教材p504)
核酸的碱基、核苷和核苷酸均能发生解离,核酸的酸碱性质与此有关。
(1)碱基的解离
(2)核苷的解离
(3)核苷酸的解离
3、核酸的紫外吸收
紫外吸收是实验室最常用的定量测定DNA或RNA的方法。(见教材p507)
核酸的摩尔磷吸光系数较所含核苷酸单体的摩尔磷吸光系数要低40%-50%,单链多核苷酸的摩尔磷吸光系数比双螺旋结构多核苷酸的摩尔磷吸光系数要高,所以核酸发生变性时,摩尔磷吸光系数值升高25%,此现象称为增色效应。复性后摩尔磷吸光系数值又降低,此现象称为减色效应。
4、核酸的变性、复性及杂交
(1)变性
A 概念:
核酸的变性:核酸双螺旋区的氢键断裂,变成单链,并不涉及共价键的断裂。
加热变性使DNA的双螺旋结果失去一半时的温度称为该DNA的熔解温度,用Tm表示。
B DNA的Tm值相关因素
DNA的均一性,G-C含量,介质中的离子强度(见教材 p509)
(2)复性
变性DNA在适当条件下,又可使两条彼此分开的链重新缔合成为双螺旋结构,这过程称复性。
(3)核酸的杂交
核酸杂交可以在液相或固相上进行,目前实验室中应用最广的是硝酸纤维素膜和尼龙膜作支持物进行的杂交。
Southern印迹法:将电泳凝胶上的DNA片段转移到硝酸纤维素膜上后,再进行杂交。
杂交必须在在较高的盐浓度及适当的温度(68°C)下进行数小时。
Northern印迹法:将RNA变形后转移到硝酸纤维素膜上再进行杂交。
Western印迹法:根据抗体、抗原可以结合的原理,分析蛋白质。
14.2本章重难点总结
核酸杂交技术
15.1本章知识点串讲
1、核酸的分离、提纯和定量测定(见教材p513)
(1)DNA的分离
(2)RNA的分离
(3)核酸含量的测定方法
2、核酸的超速离心(见教材p515)
(1)核酸密度的测定
(2) 测定DNA中G-C之含量
(3)溶液中核酸构象的研究
(4)用于核酸的制备
3、核酸的凝胶电泳
(1)琼脂糖凝胶电泳:以琼脂糖作为支持物
电泳的迁移率决定于以下因素:
核酸分子大小、胶浓度、DNA的构象、电压、碱基组成、温度。
琼脂糖凝胶电泳常用于分析DNA。
(2)聚丙烯酰胺凝胶电泳:以聚丙烯酰胺作为支持物
聚丙烯酰胺一般不含有RNase,用于RNA的分析。
聚丙烯酰胺强度较好,常用垂直板电泳。
4、核酸的核苷酸序列测定
(1)DNA的酶法测序
(2)DNA的化学法测序
基本原理(见教材p518)
(3)RNA的测序
A 用酶特异切断RNA链
B 用化学试剂裂解RNA
C 逆转录成cDNA
5、DNA聚合酶链式反应(PCR)
PCR体外快速扩增DNA的方法。
PCR的实验原理及方法。(见教材p519)
6、DNA的化学合成(了解 见教材p520)
15.2本章重难点总结
15.2.1重难点知识点总结
1、核酸的核苷酸序列测定
2、DNA聚合酶链式反应(PCR)
15.2.2本章重难点例题讲解
【例题1】解释PCR并简要叙述PCR反应的过程。
解析:
16.1本章知识点串讲
1、抗生素的概况
(1)定义:抗生素是微生物代谢过程中产生的,在低浓度下就能抑制它种微生物的生长和活动,甚至杀死他种微生物的化学物质。
(2)常见抗生素
A 青霉素:主要抑制革兰氏阳性细菌。
青霉素的抗菌作用与抑制细胞壁的合称相关。
B 链霉素:主要抑制革兰氏阴性细菌。
革兰氏阳性细菌与革兰氏阴性细菌的差异。
2、抗生素的抗菌作用机制 (见教材 p542)
(1)抑制核酸的合成
(2)抑制蛋白质的合成
(3)改变细胞膜的通透性
(4)干扰细胞壁的形成
(5)作用于能量代谢系统和作为抗代谢物
17.1本章知识点串讲
1、概述
(1)概念:激素是生物体内特殊组织或腺体产生的,直接分泌到体液中,通过体液运送到特定作用部位,从而引起特殊激动效应(调节控制各种物质代谢或生理功能)的一群微量的有机化合物。
(2)化学本质:
激素按照化学本质可以分为三类:
A 含氮激素(蛋白质、多肽类激素、氨基酸衍生物激素)
B 固醇类激素
C 脂肪酸衍生物激素
(3)激素的合成与分泌 (见教材p554)(了解)
(4)激素的作用机制 (见教材p571)(了解)
(5)激素的分泌调节(见教材p582)(了解)
(6)植物激素 (见教材p584)(了解)
18.1本章知识点串讲
1、生物膜的组成和性质
生物膜主要由蛋白质、脂质和糖类组成,还有水和金属离子。
(1)膜脂
A 膜脂的种类:生物膜内的脂质有磷脂、胆固醇、糖脂等。(见教材 p590)
B 膜脂的多态性:膜脂是两亲性分子,因此膜脂在水溶液中的溶解度是很有限的。
(2)膜蛋白:膜周边蛋白和膜内在蛋白
A 外周蛋白质:易于分离,都溶于水。
B 膜内在蛋白质:主要靠疏水力与膜脂相结合。
2、生物膜的分子结构
生物膜是由蛋白质、脂质和糖类组成的超分子体系。
(1)生物膜中分子间作用力:静电力、疏水力、范德华力
(2)生物膜结构的几个主要特征:(见教材p596)
A 膜组分的不对称分布
B 生物膜的流动性
a 膜脂的流动性
b 膜蛋白的运动性
(3)生物膜分子的结构模型
流体镶嵌模型:突出膜的流动性、显示了膜蛋白分布的不对称性。
18.2本章重难点总结
18.2.1重难点知识点总结
1、生物膜的流体镶嵌模型。
18.2.2本章重难点例题讲解
【例题1】题目: 生物膜的流体镶嵌模型的要点是什么?
解析:
19.1本章知识点串讲
营养物质在生物体内所经历的一切化学变化总称为新陈代谢。
新陈代谢可以概括为5个方面:
从周围环境中获得营养物质
将外界引入的营养物质转变为自身需要的结构元件,即大分子的组成前体
将结构元件装配成自身的大分子,如蛋白质、核酸、脂类及其他组分。
形成或分解生物体特殊功能所需的生物分子
提供生命活动所需的一切能量。
1、分解代谢与合成代谢
概念:分解代谢:有机营养物,不管是从外界环境获得的还是自身储存的,通过一系列反应步骤转变为较小的、较简单的物质的过程叫做分解代谢。
合成代谢又称生物合成,是生物体利用小分子或者大分子的结构元件建造成自身大分子的过程。
2、能量代谢在新陈代谢中的重要地位
ATP并不是能量的储存形式,而是一种传递能量的分子。
3、辅酶I和辅酶II的递能作用
由营养物质分解代谢释放出的化学能,除了通过合成ATP的途径捕获外,还有另外一种途径,就是以氢原子和电子的形式将自由能转移给生物合成的需能反应。这种具有高能的氢原子是由脱氢反应形成的。脱氢酶催化物质的脱氢反应,将脱下的氢原子和电子传递给一类特殊能接受这种氢原子和电子的辅酶,称为辅酶I和辅酶II。
4、FMN和FAD的递能作用
FMN:黄素腺嘌呤单核苷酸
FAD:黄素腺嘌呤二核苷酸
它们是一类在传递电子和氢原子中起作用的载体。
FMN和FAD都能接受两个电子和两个氢原子,它们在氧化还原反应中,特别是在氧化呼吸链中起着传递电子和氢原子的作用。
5、辅酶A在能量代谢中的作用
辅酶A(CoA)分子中含有腺嘌呤、D-核糖、磷酸、焦磷酸、泛酸和巯基乙胺。
乙酰辅酶A的结构:(见教材p5)
6、新陈代谢的调节
三个不不同水平:分子水平、细胞水平和整体水平。
7、代谢中常见的有机反应机制
酶催化的有机反应机制可归纳为以下几种:酸碱催化、公价催化、金属离子催化和静电催化。
生物化学中的反应可归纳为四类:基团转移反应、氧化-还原反应、消除、异构化和重排反应、碳-碳键的形成或断裂反应。
(1)基团转移反应(见教材 p7)
酰基转移、磷酰基转移、葡糖基转移
(2)氧化-还原反应:电子得失的反应(见教材 p9)
(3)消除、异构及重排反应(见教材p10)
(4)碳-碳键的形成或断裂反应 (见教材p12)
8、新陈代谢的研究方法
(1)使用酶的抑制剂
酶的抑制剂可以使代谢途径受到阻断,结果造成某一种代谢中间物的积累,从而为测定该中间代谢物提供可能。
(2)利用遗传缺欠症研究代谢途径
(3)同位素示踪法
放射自显影法:将带有放射性标记的化合物与照相的感光片放在一起,利用放射性能使感光片感光的性质测定感光片变黑的部分。
(4)核磁共振波谱法
19.2本章重难点总结
代谢的相关概念及辅酶。
20.1本章知识点串讲
1、有关热力学的一些基本概念
燃烧热:将1mol的有机化合物完全氧化所释放出的最大能量。
自由能:能用于做功的能量。
内能是体系内部质点能量的总和,通常用符号U或E表示。
焓又称为热焓,用H表示。焓也是体系的一个状态函数,它是一个体系的内能与其全部分子的压力和体积总变化之和。
熵代表体系能量分散程度的状态参数,用S表示。
注:氧化作用所放出的总能量的多少,与该物质的氧化途径无关,只要氧化后所生成的产物相同,释放出的总能量必然相等。
一个反应体系的过程在自发进行时,其熵是可能降低的,但其周围环境的熵必然增加,它们的总和必然是正值。
2、化学反应中自由能的变化和意义
(1)自由能公式:(见教材 p28)
△G=△H-T△S
(2)标准自由能变化和化学平衡的关系(见教材p28)
标准条件:温度
压强
参加反应物的浓度
标准自由能变化的符号用△G0表示,pH为7时,标准自由能用△G0’ 表示。
注:△G0和△G之间的区别
△G0是在特定条件下,一个化学反应得常数,每一个化学反应都有其特定的标准自由能。
△G是在某一化学反应随参加反应物的浓度、发生反应得pH和温度而改变的自由能变化。
根据反应物和产物计算出的△G值,可判断一个化学反应能否按照预想的方向进行。只有当△G值是负值时,反应才能进行。
一个化学反应自由能的变化△G,有两部分决定,一部分是不变因素,即由反应物本身的性质所决定,另一部分是可变因素,即反应物和产物的浓度,反应的化学当量以及反应的温度。
G0’=-2.303RTlgK’eq R为气体常数
(3)标准生成自由能及应用
概念:由处于标准状态的最稳定单质合成标准状态当量化合物时,其标准自由能的变化值。(△G0f)
(4)△G0’ 、△G以及平衡常数计算的举例(见教材p32)
3、高能磷酸化合物
(1)高能磷酸化合物及其他高能化合物的类型(见教材p34)
A 磷氧键型(-O-P)
B 氮磷键型——如胍基磷酸化合物
C 硫酯键型——活性硫酸基
D 甲硫键型——活性甲硫氨酸
(2)ATP的结构特性
ATP是一分子腺嘌呤、一分子核糖和三个相连的磷酸基团构成的核苷酸。
(3)ATP系统的动态平衡
细胞所处的能量状态用ATP、ADP和AMP之间的关系式来表示,称为能荷。
能荷=? (见教材p42)
20.2本章重难点总结
化学反应中自由能的变化和意义
21.1本章知识点串讲
生物膜的主要功能:能量转换、物质运输、信息识别与传递
1、被动运输与主动运输
(1)被动运输
物质从高浓度的一侧,通过膜运输到低浓度的一侧,即顺浓度梯度的方向跨膜运输的过程。
主要特点:(见教材p46)
(2)主动运输
物质逆浓度梯度运输的过程。
主要特点(见教材p47)
2、小分子物质的运输 (见教材p49)
(1)Na+、K+的运输
无论植物还是动物细胞中,细胞内外存在着离子梯度差,细胞内是高K+ 低Na+,而外环境中则是高Na+低K+
A Na+,K+-泵就是分布于膜上的Na+,K+-ATP酶。
B Na+,K+-ATP酶的作用机制——构象变化假说
(2)Ca2+的运输
(3)三类驱动离子的ATP酶:P、F、V型(见教材p52)
基本功能:通过水解ATP提供的能量转运离子,或者通过离子梯度合成ATP。
(4)糖和氨基酸的运送
A 协同运输
在小肠或肾细胞中葡萄糖的运输是伴随Na+ 一起输入细胞的,这种运输称为协同运输。
B 基团运输
有些糖在通过细菌荚膜时,需要进行磷酸化反应加入一个磷酸基团,以糖-磷酸的形式才能通过膜,称为基团运输。
3、生物大分子的跨膜运输
多核苷酸、多糖等生物大分子甚至颗粒物的运输,主要通过胞吞和胞吐作用,包括受体介导的内吞作用等运输的。
(1)胞吐作用:细胞内物质先被囊泡裹入,形成分泌泡,然后与细胞质膜接触、融合并向外释放被裹入的物质,这个过程,称为胞吐作用。
(2)胞吞作用:细胞从外界摄入的大分子或颗粒逐渐被质膜的一小部分包围,内陷,其后从质膜上脱下来而形成含有摄入物质的细胞内囊泡的过程,称为胞吞作用。
A 吞噬作用
B 胞饮作用
C 受体介导的胞吞作用
22.1本章知识点串讲
ATP形成主要通过两条途径:有氧呼吸和无氧呼吸
在无氧条件下,葡萄糖进行分解,形成2分子丙酮酸并提供能量,这一过程称为糖酵解作用。糖酵解是葡萄糖分解代谢所经历的共同途径。
1、糖酵解过程的概述
(1)糖酵解的生物学意义:在不需要氧供应的条件下,产生ATP的一种功能方式。
(2)酵解作用的反应式:
C6H12O6+2Pi+2ADP——2CH3CH(OH)COO-+2ATP+2H2O+2H+
葡萄糖 无机磷酸 乳酸
(3)酒精发酵作用的反应式
C6H12O6+2Pi+2ADP——2CH3CH2OH+2 H2O +2CO2
乙醇
(4)从酵解总的能量变化来看,是一个放能过程,因此是一个不可逆的反应。
糖酵解由葡萄糖到所有的中间产物都是以磷酸化合物的形式来实现的。中间产物磷酸化的意义:
A 带有负电荷的磷酸基团使中间产物具有极性,从而使这些产物不易透过膜而散失。
B 磷酸基团在各反应步骤中,对酶来说,起到信号基团的作用,有利于与酶结合而被催化。
C 磷酸基团经酵解作用后,最终形成ATP的末端磷酸基团,具有保存能量的作用。
(5)糖酵解过程从葡萄糖到丙酮酸共包括十步反应,可划分为两个主要阶段:
前五步为准备阶段:葡萄糖经过磷酸化、异构化裂解为三碳糖。每裂解一个己糖分子,共消耗两分子ATP
后五步为产生ATP的贮能阶段:磷酸三碳糖转变成丙酮酸。
注:整个过程中需要10种酶,这些酶都存在于胞质溶胶中。大部分过程有Mg2+作为辅助因子。
2、糖酵解和酒精发酵的全过程图解
酵解和酒精发酵基本路线完全相同,只是在形成丙酮酸以后才有差异。丙酮酸转化为乳酸时称为酵解,丙酮酸转化为乙醛、乙醇时,称为发酵。
具体图解见教材 p67
3、糖酵解第一阶段的反应机制
第一阶段包括5个步骤,即准备阶段
(1)葡萄糖的磷酸化
葡萄糖+ATP——葡萄糖-6-磷酸+ADP+H+
这是一个基团转移的反应,即ATP的磷酸基团在己糖激酶的催化下,转移到葡萄糖分子上。这个反应必须有Mg2+的存在。己糖激酶是一种调节酶。它催化的反应产物葡萄糖-6-磷酸和ADP能使该酶受到变构抑制。
(2)葡萄糖-6-磷酸异构化形成果糖-6-磷酸
葡萄糖-6-磷酸——果糖-6-磷酸
这是一个可逆反应。催化这一反应的酶是磷酸葡萄糖异构酶,又成磷酸葡糖异构酶。
(3)果糖-6-磷酸形成果糖-1,6-二磷酸
果糖-6-磷酸+ATP——果糖-1,6-二磷酸+ADP+H+
这是一个不可逆反应。催化此反应的酶称为磷酸果糖激酶。该酶需要Mg2+参加反应。磷酸果糖激酶是一种变构酶,它是哺乳动物糖酵解途径最重要的调控关键酶,该酶由4个亚基组成,是一个四聚体。
(4)果糖-1,6-二磷酸转变为甘油醛-3-磷酸和二羟丙酮磷酸
果糖-1,6-二磷酸——二羟丙酮磷酸+甘油醛-3-磷酸
这是一个可逆反应。催化此反应的酶为醛缩酶。
(5)二羟丙酮磷酸转变成甘油醛-3-磷酸
二羟丙酮磷酸——甘油醛-3-磷酸
催化此反应的酶为丙糖磷酸异构酶。
4、糖酵解第二阶段——放能阶段的反应机制
酵解的准备阶段包括两个磷酸化步骤由六碳糖裂解为两分子三碳糖,最后都转变成甘油醛-3-磷酸。在准备阶段中,并没有从中获得任何能量,还消耗了2分子ATP。以下的5步反应包括:氧化-还原反应、磷酸化反应。这些反应从甘油醛-3-磷酸提取能量形成ATP分子。
(1)甘油醛-3-磷酸氧化成1,3-二磷酸甘油酸
甘油醛-3-磷酸+NAD++Pi——1,3-二磷酸甘油酸+NADPH+H+
这是一个可逆反应。催化此反应的酶为甘油醛-3-磷酸脱氢酶。
(2)1,3-二磷酸甘油酸转移高能磷酸基团形成ATP
这是糖酵解过程的第七步,也是糖酵解过程开始收获的阶段。
1,3-二磷酸甘油酸+ADP——3-磷酸甘油酸+ATP
该反应是一个高效的放能反应,催化此反应的酶称为磷酸甘油酸激酶,该酶需要Mg2+参加反应。
(3)3-磷酸甘油酸转变为2-磷酸甘油酸
3-磷酸甘油酸——2-磷酸甘油酸
催化此反应的酶称为磷酸甘油酸变位酶。
(4)2-磷酸甘油酸脱水生成磷酸烯醇式丙酮酸
2-磷酸甘油酸——磷酸烯醇式丙酮酸
这一反应是可逆反应,,催化此反应的酶是烯醇化酶,该酶需要Mg2+、Mn2+参加反应。
(5)磷酸烯醇式丙酮酸转变为丙酮酸并产生一个ATP分子
磷酸烯醇式丙酮酸+ADP+Pi——丙酮酸+ATP
催化此反应的酶为丙酮酸激酶,丙酮酸激酶的催化活性需要2价阳离子参与,如Mg2+和Mn2+。它是糖酵解途径中一个重要变构调节酶。5、由葡萄糖转变为两分子丙酮酸能量转变的估算
总反应式:葡萄糖+2Pi+2ADP+2NAD+——2丙酮酸+2ATP+2NADH+2H++2 H2O
糖酵解过程中ATP的消耗和产生(见教材 p80)
6、丙酮酸的去路(无氧条件下)
(1)生成乳酸
丙酮酸+NADH+ H+——乳酸+ NAD+
催化此反应的酶为乳酸脱氢酶。
(2)生成乙醇
A 丙酮酸脱羧形成乙醛
B 乙醛还原成乙醇同时产生氧化型NAD+
7、糖酵解作用的调节
(1)磷酸果糖激酶是关键酶
磷酸果糖激酶受到高浓度ATP的抑制
(2)果糖-2,6-二磷酸对酵解的调节作用
(3)己糖激酶和丙酮酸激酶对糖酵解的调节作用
22.2本章重难点总结
22.2.1重难点知识点总结
1、糖酵解的全过程
2、糖酵解过程中ATP的计算
22.2.2本章重难点例题讲解
【例题1】1分子葡萄糖转变成丙酮酸的能量估算。
解析:
23.1本章知识点串讲
有氧条件下,葡萄糖氧化分解形成二氧化碳和水,它所经历的途径分为两个阶段:柠檬酸循环和氧化磷酸化。
柠檬酸循环的来由:在循环的一系列反应中,关键的化合物是柠檬酸,它有三个羧基,又称三羧酸循环,简称TCA循环。这一循环也称Krebs循环。
柠檬酸循环是在细胞的线粒体中进行的,丙酮酸通过柠檬酸循环进行脱羧和脱氢反应,羧基形成二氧化碳,氢原子则随着则载体(NAD+、FAD)进入电子传递链经过氧化磷酸化作用,形成水分子并将释放出的能量合成ATP。柠檬酸循环的中间体还可以作为许多生物合成的前体,也可以说柠檬酸循环是两用代谢途径。
丙酮酸进入柠檬酸循环之前需要先转变为乙酰辅酶A或称为乙酰-CoA。乙酰-CoA是许多物质例如脂肪酸降解的中间产物。
1、丙酮酸进入柠檬酸循环的准备阶段——形成乙酰-CoA
催化丙酮酸转变成乙酰-CoA的酶是包括丙酮酸脱氢酶在内的多酶复合体,由三种酶高度组合在一起形成的。
丙酮酸+ CoA-SH+ NAD+——乙酰辅酶A+CO2+NADH
参与此反应不仅有CoA-SH和 NAD+ 两种辅助因子,还有硫胺素焦磷酸(TPP),硫辛酰胺和黄素腺嘌呤二核苷酸(FAD)等。
参与此反应的三种酶分别为:丙酮酸脱氢酶组分、二氢硫辛酰转乙酰基酶、二氢硫辛酸脱氢酶。
2、柠檬酸循环概貌(图示见教材p97)
柠檬酸循环的起始步骤可以看作是由4个碳原子的化合物(草酰乙酸)与循环外的两个碳原子的化合物(乙酰—CoA)形成6个碳原子的柠檬酸。柠檬酸经过三步异构化称为异柠檬酸,然后进行氧化(形成6个碳原子的草酰琥珀酸),再脱羧失去一个碳原子形成5个碳原子的二羧酸化合物(a-酮戊二酸)。5碳化合物又氧化脱羧形成4碳二羧酸化合物(琥珀酸)。4碳化合物经过三次转化,其间形成一个高能磷酸键(GTP),使FAD+、NAD+分别还原为FADH2和NADH,最后又形成4个碳原子的草酰乙酸。
(详述见p98)
3、柠檬酸循环的反应机制
柠檬酸循环共8个步骤(见教材p99)
(1)草酰乙酸与乙酰辅酶缩合形成柠檬酸
草酰乙酸+乙酰-CoA——柠檬酸+辅酶A
催化此反应的酶是柠檬酸合酶。柠檬酸合酶属于调控酶,它的活性受ATP、NADH、琥珀酰-CoA、酯酰-CoA等的抑制。它是柠檬酸循环中的限速酶。
(2)柠檬酸异构化形成异柠檬酸
柠檬酸——成异柠檬酸
催化此反应的酶是乌头酸酶。
(3)异柠檬酸氧化形成a-酮戊二酸
异柠檬酸+NADP++NAD++H+——a-酮戊二酸+CO2
柠檬酸循环中包括4个氧化-还原步骤。异柠檬酸氧化脱羧是一个氧化-还原步骤,也是柠檬酸循环中两次氧化脱羧反应中的第一个反应。催化此反应的酶是异柠檬酸脱氢酶。
异柠檬酸脱氢酶有两种,一种以NAD+为辅酶,一种以NADP+为辅酶。以NAD+为辅酶的异柠檬酸脱氢酶需要有Mg2+或Mn2+激活。异柠檬酸脱氢酶是一个变构调节酶,它的活性受ADP变构激活。
(4)a-酮戊二酸氧化脱羧形成琥珀酰-CoA
a-酮戊二酸+ NAD++CoASH——琥珀酰-CoA+NADH+ H++ CO2
这是柠檬酸循环两次氧化脱羧作用中的第二次脱羧。该反应需要NAD+和CoA作为辅助因子。催化上述反应的酶是a-酮戊二酸脱氢酶。该酶也是一个多酶复合体,属于变构调节酶。
(5)琥珀酰-CoA转化成琥珀酸并产生一个高能磷酸键
琥珀酰-CoA+GDP+Pi——琥珀酸+ CoA-SH
这是柠檬酸循环中唯一直接产生一个高能磷酸键的步骤。催化此反应的酶是琥珀酰-CoA合成酶。
(6)琥珀酸脱氢形成延胡索酸
琥珀酸+FAD——FADH2+延胡索酸
催化此反应的酶是琥珀酸脱氢酶,这个酶是以FAD作为其脱下电子的受体,不是NAD+。琥珀酸脱氢酶与柠檬酸循环中的其他酶不同,是唯一嵌入到线粒体内膜的酶,是线粒体内膜的一个重要组成部分,而其他的酶大多存在于线粒体的基质。
(7)延胡索酸水合形成L-苹果酸
延胡索酸+H2O——苹果酸 催化此反应的酶是延胡索酸酶。
(8)L-苹果酸脱氢形成草酰乙酸
L-苹果酸——草酰乙酸
催化此反应的酶是苹果酸脱氢酶,它的辅基是NAD+。
4、柠檬酸循环的化学总结算
柠檬酸循环的总化学反应式:
乙酰-CoA+3NAD++FAD+GDP+Pi——2CO2+3NADH+FADH2+GTP+2H++CoA-SH
柠檬酸循环的每一次循环都纳入一个乙酰-CoA分子,即两个碳原子进入循环,又有两个碳原子以CO2的形式离开循环,但离开的两个碳原子并非进入的两个碳原子。
每一次循环共有4次氧化反应,参加这4次氧化反应的有3个NAD+ 分子和一个FAD分子,同时有4个氢原子离开循环,形成3个NADH和一个FADH2。
每一次循环以GTP的形式产生一个高能磷酸键,并消耗两个水分子。
在柠檬酸循环中,虽然没有氧分子直接参加反应,但是柠檬酸循环只在有氧条件下进行。
柠檬酸循环总结算:柠檬酸循环共有4个脱氢步骤,其中有3对电子经NADH转递给电子传递链,最后与氧结合生成水。每对电子经过化学计算产生2.5个ATP分子,3对电子共产生7.5个ATP分子,一对电子经FADH2转移给电子传递链,化学计算产生1.5个ATP分子,通过柠檬酸循环本身,只产生一个ATP(GTP)分子。每循环一次产生ATP:3*2.5+1.5+1=10个分子。
从丙酮酸开始经过一次循环共产生2.5+10=12.5个分子。
从葡萄糖开始计算:2*12.5+2+2*2.5=32
23.2本章重难点总结
23.2.1重难点知识点总结
1、柠檬酸循环的全过程
2、柠檬酸循环中能量的应用
23.2.2本章重难点例题讲解
【例题1】计算一分子丙酮酸氧化分解所生成的ATP量。
解析:
24.1本章知识点串讲
生物氧化:有机分子在细胞内氧化分解成二氧化碳和水并释放出能量形成ATP的过程。
生物氧化的特点:在体温条件下进行,通过酶的催化作用,有机分子发生一系列的化学变化,在此过程中逐步氧化并释放能量;在氧化过程中产生的能量一般都贮存在一些特殊的化合物中,主要是ATP。
生物氧化实质上是指氧化磷酸化,是NADH和FADH2上的电子通过一系列电子传递载体传递给O2,伴随NADH和FADH2的再氧化,将释放的能量使ADP磷酸化形成ATP的过程。
1、电子传递和氧化呼吸链
(1)电子传递的过程
电子传递过程包括电子从还原型辅酶通过通过一系列按照电子亲和力递增顺序排列的电子载体所构成的电子传递链传递到氧的过程。这些电子载体都具有氧化-还原作用。电子传递和形成ATP的偶联机制称为氧化磷酸化作用。
氧化磷酸化作用是电子在沿着电子传递链传递过程中所伴随的,将ADP磷酸化而形成ATP的全过程。这个过程又称为氧化呼吸和呼吸代谢。
(2)呼吸链的建立
在生物氧化过程中,氢的激活和氧的激活都是需要的。呼吸酶和脱氢酶之间起电子传递作用的是黄素蛋白类物质,细胞色素起着连续传递电子的作用。
(3)电子传递链
电子从NADH到O2的传递所经过的途径形象地称为电子传递链,或称呼吸链。这条链主要是由蛋白质复合体组成,大致分为4个部分,分别称为NADH-Q还原酶、琥珀酸-Q还原酶、细胞色素还原酶和细胞色素氧化酶。(见教材p120)
电子传递酶复合体的辅基有:黄素类、铁硫集团、血红素、铜离子。这些辅基都是电子载体。电子载体都通过与酶分子结合的辅基来完成。
(4)电子传递链各个成员(见教材 p121)
A NADH-Q还原酶:
NADH-Q还原酶又称NADH脱氢酶,简称为复合体I,是一个大蛋白质分子。分别由核和线粒体两个不同的基因组编码构成。在电子传递链中共有哦3个质子泵,该酶是第一个质子泵。
B 辅酶Q:
辅酶Q又称为泛醌,有时简称为Q,是脂溶性辅酶。
C琥珀酸-Q还原酶:这一步反应没有ATP的形成。
D 细胞色素还原酶 又称复合体III,细胞色素bc1复合体。
E 细胞色素c:唯一能溶于水的细胞色素。
F 细胞色素氧化酶
(5)电子传递的抑制剂 (见教材p128)
3、氧化磷酸化作用
氧化磷酸化是需氧细胞生命活动的主要能量来源,是生物产生ATP的主要途径。氧化磷酸化作用是指与生物氧化作用相伴而生的磷酸化作用,是将生物氧化过程中释放的自由能,用以使ADP和无机磷酸生成高能ATP的作用。
(1)氧化磷酸化作用机制
伴随电子从底物到氧的传递,ADP被磷酸化形成ATP的酶促过程即是氧化磷酸化作用。氧化磷酸化的全过程可用方程式表示如下:
NADH+H++3ADP+3Pi+1/2O2——NAD++4H2O+3ATP
氧化磷酸化作用是指直接与电子传递相偶联的由ADP形成ATP的磷酸化作用。
底物水平磷酸化是指ATP的形成直接由一个代谢中间产物上的磷酸基团转移到ATP分子上的作用。
每消耗1个O2分子约合成3个ATP分子,这个比例关系称为P/O比。P/O比可以看做是当一对电子通过呼吸链传至O2所产生的ATP分子数。
A 、ATP的合成部位
ATP的合成是在线粒体内膜由电子传递链将NADH和FADH2上的电子传递给氧的过程中释放出自由能供给ATP合成,
B 、能量偶联假说 (见教材p131)
a 化学偶联假说
b 构象偶联假说
c 化学渗透假说
(4)ATP合成机制(见教材p134)
ATP的合成是由一个酶的复合体系完成的,这个复合体系称为ATP合酶。这个酶由两个主要的单元组成。起质子通道作用的单元称Fo单元,催化ATP合成的单元称为F1单元。ATP合酶又称为FoF1-ATP酶。
(5)细胞溶胶内NADH的再氧化
细胞溶胶内的NADH不能透过线粒体内膜进入线粒体氧化。通过“穿梭”途径解决NADH再氧化的问题,分别介绍如下:
A 甘油-3-磷酸穿梭途径在传递NADH电子中的特殊作用 ——1.5个ATP(见教材p139)
B 苹果酸-天冬氨酸穿梭途径 ——2.5个ATP (见教材p139)
24.2本章重难点总结
1、生物氧化、呼吸链等概念
2、电子传递过程及能量计算
25.1本章知识点串讲
1、戊糖磷酸途径
(1)戊糖磷酸途径的主要反应
戊糖磷酸途径是糖代谢的第二条重要途径,它是葡萄糖分解的另外一种机制。这条途径在细胞溶胶内进行,广泛存在于动植物细胞内。
该反应体系的起始物是葡萄糖-6-磷酸,经过氧化分解后产生五碳糖、CO2、无机磷酸和NADPH即还原型烟酰胺腺嘌呤二核苷酸磷酸。
戊糖磷酸途径的核心反应:
葡萄糖-6-磷酸+2NADP++H2O——核糖-5-磷酸+2NADPH+2H++CO2
一般将反应分为氧化阶段和非氧化阶段:(戊糖磷酸途径总览 p151)
A 氧化阶段(见教材p148)
这个阶段包括六碳糖脱羧形成五碳糖并使NADP+还原形成还原型NADPH。
该氧化阶段包括三步反应。
B 非氧化阶段 (见教材 p149)
(2)戊糖磷酸途径反应速度的调控
戊糖磷酸途径氧化阶段的第一步反应,即葡萄糖-6-磷酸脱氢酶催化的葡萄糖-6-磷酸的脱氢反应,实质上是不可逆的。在生理条件下属于限速反应,是一个重要的调控点。最重要的调控因子是NADP+的水平。
(3)戊糖磷酸途径的重要生物学意义(见教材 p153)
A 戊糖磷酸途径是细胞产生还原力的主要途径
B 戊糖磷酸途径是细胞内不同结构糖分子的重要来源,并为各种单糖的相互转化提供条件。
2、糖的其他代谢途径
(1)葡萄糖异生作用
葡萄糖异生作用指的是以非糖物质作为前体合成葡萄糖的作用。非糖物质包括乳酸、丙酮酸、丙酸、甘油以及氨基酸等。
A 葡萄糖异生作用的途径
a 葡萄糖异生和糖酵解作用的关系
葡萄糖异生并不是糖酵解作用的直接逆反应。糖酵解过程是放能反应,其中有三步是不可逆的。(见教材p154)葡萄糖异生对3个不可逆过程采取迂回措施。
b 糖异生对糖酵解的不可逆过程采取的迂回措施如下:
丙酮酸通过草酰乙酸形成磷酸烯醇式丙酮酸。
果糖-1,6-二磷酸在果糖-1,6-二磷酸酶催化下,形成果糖-6-磷酸。
葡萄糖-6-磷酸在葡萄糖-6-磷酸酶催化下水解为葡萄糖。
(2)葡萄糖异生总览 (见教材 p157)
3、乙醛酸途径
乙醛酸途径又称乙醛酸循环,这一途径在动物体内并不存在,只存在于植物和微生物中,它的主要内容实际是通过乙醛酸途径使乙醛-CoA转变为草酰乙酸从而进入柠檬酸循环。
催化乙醛酸循环的酶既存在于线粒体,也存在于一种为植物膜所特有的亚细胞结构称为乙醛酸循环体,特别包括只存在于乙醛酸循环体中的两种酶,即异柠檬酸裂合酶和苹果酸合酶。
乙醛酸途径示意图(p160)
乙醛酸循环的全部反应可看作是将两个乙酰-CoA分子转变为一分子草酰乙酸,同时将2分子NAD+和1分子FAD还原。
2乙酰-CoA+ 2NAD++FAD——草酰乙酸+2CoASH+2NADH+FADH2+2H+
4、寡糖类的生物合成和分解(见教材p161)
25.2本章重难点总结
1、糖异生作用
2、乙醛酸循环
26.1本章知识点串讲
葡聚糖中葡萄糖的连接形式有两种:一种是以a(1-4)糖苷键相连接,另一种是在多糖分子的分支处,以a(1-6)糖苷键的形式相连接。
1、糖原的生物学意义
糖原是葡萄糖的一种高效贮能形式。
2、糖原的降解(见教材 p177)
糖原的降解需要三种酶的作用:糖原磷酸化酶,糖原脱支酶,磷酸葡萄糖变位酶。
3、糖原的生物合成 (见教材 p183)
糖原的生物合成和分解走的是完全不同的途径。
催化糖原合成的三种酶:UDP-葡萄糖焦磷酸化酶、糖原合酶、糖原分支酶。
27.1本章知识点串讲
光合作用可以简单地概括为含光合色素主要是叶绿素的植物细胞和细菌,在日光下利用无机物质(CO2、H2O、H2S等)合成有机化合物(C6H12O6),并释放氧气(O2)或其他物质(如S等)的过程。
1、光合作用的概况
(1)光合作用的场所
光合作用都是在膜上发生的,光合膜位于叶绿体内。叶绿体的共同特点是一种内膜系统的组织形式,即所谓类囊体膜。
叶绿体是一种半自主性细胞器。
(2)光合作用的总过程
A 光合作用的一般化方程式
CO2+H218O——(CH2O)+18O2
B 光反应和暗反应
光反应在类囊体膜上进行,利用日光使H2O裂解,释放出O2,并生成高能磷酸化合物(ATP)和还原力(NADPH)。暗反应在基质中进行 ,利用光反应形成的ATP将CO2还原为糖。暗反应并不需要光的直接参与。
2、叶绿素的光反应:光吸收(见教材p201)
(1)叶绿素吸收光能
叶绿素是含镁的四吡咯衍生物。高等植物的叶绿体同时含有叶绿素a和叶绿素b。
(2)辅助色素扩展光吸收的范围
除叶绿素外光合色素还有藻胆素和类胡萝卜素两类。
(3)叶绿素在膜上被组织成光合单位
叶绿体在光合作用中担当两种角色:一是参与光的收集,并通过激子转移将光能传递到光反应性部位;二是光反应性部位的叶绿素分子直接参与光化学事件,借此光能转变成化学能。
3、光驱动电子流:中心光化学事件
(1)高等植物和藻类具有两个光系统(见教材p208)
A 红降:在较短波长(<680nm)光下,光合的量子效率是恒定的,但在波长>680nm波长的远红光区光合效率则剧烈下降。
B P700是光系统I(PSI)的作用中心色素,其红光端的最大吸收在700nm波长。
P680是光系统II(PSII)的作用中心,在680nm波长呈现最大红光吸收。P700和p680都是处于特化蛋白质复合体中的叶绿素a分子二聚体或“特殊对”。
C 叶绿素是以缀合蛋白质形式存在于光合膜中
(2)真核光合电子传递的Z图示
光系统I和光系统II是以串联方式作用的。真核光合细胞中由p680和p700吸收的光能驱动电子从H2O流向NADP+。PSI以NADPH的形式提供还原力,PSII光解水和放氧,并把释放的电子送入连接光系统II和光系统I的电子传递链。在电子传递过程中引起质子跨膜泵送和ATP合成。H2O的氧化和NADP+的还原在类囊体膜上是分开的,氧化在PSII这边进行,还原在PSI这边进行。
含有两个光系统的生物,还原NADP+ 所需的电子最终来自H2O的氧化,释放的O2是水光解的副产物,这一过程称为生氧光合作用。所有放氧光合细胞都含有两个光系统。
4、光驱动的ATP合成:光合磷酸化
被生物的光系统捕获的光能一部分能量转化为ATP的磷酸键能,这一过程称为光磷酸化。
(1)电子传递与光合磷酸化相偶联 (见教材p216)
(2)光合磷酸化的机制:化学渗透(见教材p216)
5、暗反应:CO2固定
(1)CO2固定与核酮糖-1,5-二磷酸羧化酶/加氧酶
A CO2固定是通过循环途径形成的
催化CO2转变为还原性的有机化合物,这一过程称为CO2固定,也叫Cavlin循环。
B 核酮糖-1,5-二磷酸是CO2固定中的CO2受体,简称为RuBP,此五碳糖与CO2结合,经不稳定的6C中间物,被裂解成两分子3-磷酸甘油酸。催化此反应的酶是核酮糖-1,5-二磷酸羧化酶/加氧酶,简称为rubisco。该酶存在于叶绿体的基质中。
(2)Cavlin循环分为三个阶段
a CO2固定成3-磷酸甘油酸。
b 3-磷酸甘油酸转变为甘油醛-3-磷酸。
c 从丙糖磷酸再生成核酮糖-1,5-二磷酸
6、光呼吸和C4途径
由于温度升高,rubisco对CO2的亲和力下降,加重该酶倾向催化浪费的加氧酶反应。在进化中产生一条从磷酸乙醇酸中抢救碳的途径称乙醇酸途径。与光有关的rubisco加氧酶活性加上此补救途径形成消耗O2,产生CO2的过程,称为光呼吸。
C4途径涉及两种类型的细胞:叶肉细胞和维管束鞘细胞。
27.2本章重难点总结
光系统的组成及光合作用中的电子传递。
28.1本章知识点串讲
脂肪酸对生物体有重要功能(见教材 p230)
脂肪酸氧化的化学步骤:一长链脂肪酸降解为两个碳原子单元,即乙酰-CoA。二乙酰-CoA经过柠檬酸循环氧化成CO2。三从还原的电子载体到线粒体呼吸链的电子传递。
1、脂肪酸的氧化
(1)脂肪酸的活化
脂肪酸分解代谢发生于原核生物的细胞溶胶和真核生物的线粒体基质中。它在进入线粒体基质前,脂肪酸先与辅酶A(CoA)形成硫酯键。这个反应是由酯酰辅酶A合酶催化发生的,此酶存在于线粒体外膜。
(2)脂肪酸进入线粒体(见教材p234)
脂肪酸在细胞溶胶中被活化,成为酯酰辅酶A,然后穿越线粒体内膜进入线粒体基质。
(3)β-氧化
脂肪酸的β-氧化发生于线粒体中,共有5个步骤,即活化、氧化、水合、氧化、断裂。
一般说β-氧化是4个步骤,不计算脂肪酸的活化步骤,线粒体中脂肪酸氧化可以看作三大步骤。
A β-氧化:脂肪酸——乙酰辅酶A,每一个乙酰辅酶A的形成需要失去4个氢原子和两对电子,每步都是在酯酰-CoA脱氢酶的作用下发生的。
B β-氧化形成的乙酰辅酶进入柠檬酸循环,继续被氧化最后脱出CO2。
C 前两大步骤中脂肪酸氧化过程产生还原型的电子传递分子—NADH和FADH2,它们在第三步骤中把电子送到电子呼吸链,经过呼吸链,电子被运送给氧原子,伴随这个电子的流动,ADP经磷酸化作用转化为ATP。
(4)脂肪酸氧化是高度的放能过程
β-氧化每一轮回产生一个NADH,一个FADH2和一个乙酰辅酶A。乙酰辅酶A进入柠檬酸循环又生成FADH2及NADH,每1分子乙酰辅酶A可产生10个ATP,每一分子NADH被氧化呼吸链氧化产生2.5个ATP,每1分子FADH2氧化产生1.5个ATP。
2、不饱和脂肪酸的氧化 (见教材p240)
3、酮体
(1)乙酰辅酶A的代谢结局
进入柠檬酸循环
合成胆固醇
作为脂肪酸合成的前体
转化为酮体:乙酰乙酸、D-β-羟丁酸、丙酮
(2)肝脏中酮体的形成
酮体的形成主要是肝脏的功能
(3)肝外组织使用酮体作为燃料
即肝内生酮肝外作用。
4、磷脂的代谢(见教材 p247)
降解磷脂的酶称为磷脂酶。
磷脂水解后最后的产物脂肪酸进入β-氧化途径,甘油和磷酸则进入糖代谢。
5、脂肪酸代谢的调节
(1)脂肪酸进入线粒体的调控
(2)心脏中脂肪酸氧化的调节
(3)激素对脂肪酸代谢的调节
(4)根据机体代谢需要的调控
(5)长时间膳食的改变导致相关酶水平的调整
28.2本章重难点总结
脂肪酸的β-氧化作用
29.1本章知识点串讲
1、脂类的生物合成
(1)脂肪酸的生物合成
A 乙酰辅酶A的作用
脂肪酸的合成在细胞溶胶中进行,包括脂肪酸链自乙酰辅酶A获得两个碳原子单元,从而增长碳链的步骤。
在线粒体产生的乙酰辅酶A必须先从线粒体转移到细胞溶胶中,才能参与脂肪酸合成。而线粒体内膜不允许乙酰辅酶A穿透,这里有一个穿梭机制取代直接的运送,这个机制称为三羧酸转运体系。
B由脂肪酸合酶催化的各步反应(见教材 p262)
启动、装载、缩合、还原、脱水、还原、释放
C 脂肪酸合成途径与β-氧化的比较(共10点)(见教材 p264)
2 其他脂类的生物合成(见教材p267 了解)
30.1本章知识点串讲
1、概念
蛋白质分解:——真核细胞对蛋白质的降解有二体系:一是溶酶体系,即溶酶体降解蛋白质,是非选种择性;二是以细胞溶胶为基础的,依赖ATP机制,即泛肽标记选择性蛋白质降解方式。
氨基酸分解:——氨基酸的分解代谢总是先脱去氨基。氨基酸的分解分三步:第一步,脱氨基,脱下的氨基或转化为氨,或转化为天冬氨酸或谷氨酸的氨基;第二步,氨与天冬氨酸N原子结合,形成尿素并排放;第三步,氨基酸的碳骨架,即脱去氨基后的α-酮酸转化为代谢中间物进入三羧酸循环。
2、氨基酸的分解代谢 (见教材p303)
(1)脱氨基方式:转氨基作用、氧化脱氨基作用、联合脱氨基作用(即转氨、氧化脱氨联合作用)。
A 转氨基(需要转氨酶):
氨基酸 +α-酮戊二 酸 ——α-酮酸+谷氨酸(占有重要地位);
谷氨酸 + 草酰乙酸 —— α-酮戊二酸+天冬氨酸
B 氧化脱氨基作用(需要谷氨酸脱氢酶):
谷氨酸 α-酮戊二酸 + NH4+ +NAD(P)H
C 联合脱氨基作用
D 氨的命运:—— 氨基酸经氧化脱氨基作用、脱酰氨基作用或经嘌呤核苷酸循环等方式将氨基氮转变为氨。氨对生物机体是有毒物质,因此氨的排泄是生物体维持正常生命活动所必需的。某些水生动物如原生动物、鱼类、两栖动物等是排氨动物;大多数陆生动物是排尿素动物;鸟类和爬虫类是排尿酸动物。氨的怎样转运和排泄?
a 氨的转运:
在血液中主要以谷氨酰胺(需谷氨酰胺合成酶)形式转运到肝脏,在肝细胞谷氨酰胺酶的作用下又变为氨,形成尿素;
在肌肉组织中,存在葡萄糖-丙氨酸循环:即产生的大量氨(通过转氨基以谷氨酸的氨基形式存在)转到丙酮酸形成丙氨酸,丙氨酸在血液中转运到肝脏,在转氨酶作用下变为丙酮酸和谷氨酸,谷氨酸进一步进行转氨基或氧化脱氨基,为合成尿素准备前体物。
b 氨的排泄:排氨动物以谷氨酰胺形式运送到排泄部位;排尿素动物在肝脏中经过尿素循环合成尿素。
3、尿素循环(在肝脏):5步酶反应,2步在线粒体,3步在细胞溶胶,共消耗3个ATP。尿素分子中1个N原子来自氨,另一个N原子来自天冬氨酸,其C(包括O)原子来自HCO3-。
在尿素循环中,参与反应的酶有:氨甲酰磷酸合成酶、鸟氨酸转氨甲酰基酶、精氨琥珀酸合成酶、精氨琥珀酸裂解酶(精氨琥珀酸酶)、精氨酸酶。其中1、2步反应在线粒体中进行,3,4,5在细胞溶胶中进行。见下图。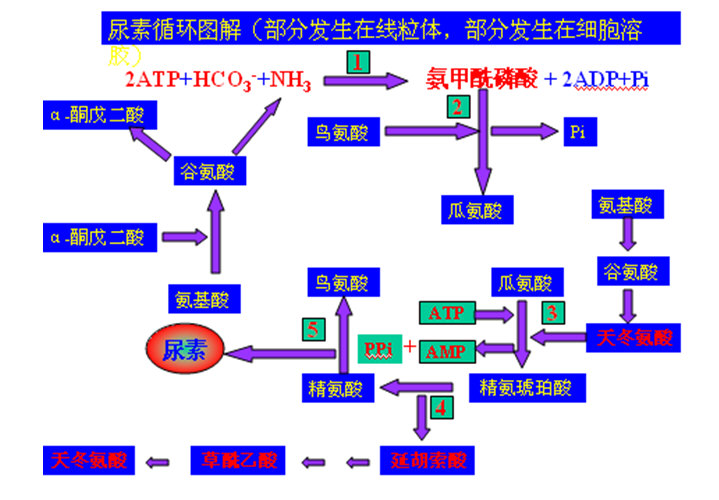
4、 氨基酸碳骨架的氧化途径——20种氨基酸脱氨后的碳骨架集中形成5种产物进入三羧酸循环,最后氧化成CO2和水:乙酰-CoA、草酰乙酸、琥珀酰-CoA、α-酮戊二酸、延胡索酸。见下图。(见教材p315)
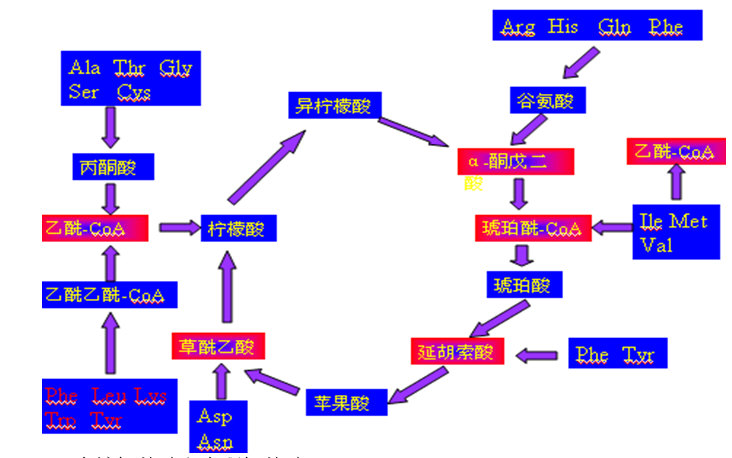
5、生糖氨基酸和生酮氨基酸
生酮氨基酸:5种(Phe\Tyr\ Trp \ Leu \Lys),其中只生酮不生糖的有Leu和Lys!因为这5种氨基酸在分解过程中可转变为乙酰乙酰-CoA,而乙酰乙酰-CoA可形成乙酰乙酸和β-羟丁酸。所以,酮体除来自于脂肪酸氧化形成的乙酰-CoA外,还可来自生酮氨基酸。
生糖氨基酸:指能形成丙酮酸或TCA循环中间物的氨基酸都称为生糖氨基酸(通过草酰乙酸进行糖异生)。而乙酰-CoA进入TCA循环发生氧化而不生成TCA中间物。植物和微生物具有乙醛酸循环途径,可由乙酰-CoA合成草酰乙酸而进行糖异生。
生酮氨基酸和生糖氨基酸的界限并不是非常严格的:因为有些氨基酸如Ile Met Val也可分解形成乙酰-CoA,故也可生成酮体。
30.2本章重难点总结
1、氨基酸的分解代谢
2、尿素循环
3、氨基酸碳骨架的氧化途径
31.1本章知识点串讲
氨基酸合成:碳骨架来自三羧酸循环、糖酵解、戊糖磷酸途径。氨来自无机氮:N2,NH3。
1、氨基酸合成类型:
三羧酸循环:α-酮戊二酸(谷氨酸族)、草酰乙酸(天冬氨酸族);
糖酵解:3-磷酸甘油酸(丝氨酸族)、丙酮酸(丙氨酸族)、磷酸烯醇式丙酮酸+4-磷酸赤藓糖(芳香族氨基酸);
戊糖磷酸途径:5-磷酸核糖(组氨酸)。
2、氨基酸合成调节:产物抑制(举例说明)、酶合成的调节
3、重要氨基酸衍生物:
NO(氧化氮):由精氨酸在氧化氮合酶催化形成,同时生成瓜氨酸;
肌酸:由甘氨酸、精氨酸、甲硫氨酸合成;
卟啉:由甘氨酸、琥珀酰-CoA合成
32.1本章知识点串讲
本章不是考试重点,学生大体了解即可。
33.1本章知识点串讲
1、核酸和核苷酸的分解代谢
(1)核酸的解聚作用
降解核酸中磷酸二酯键的酶称为核酸酶。核酸酶根据底物不同,分为DNA酶和RNA酶;根据对底物作用方式,又分为核酸内切酶和核酸外切酶。
(2)核苷酸的分解代谢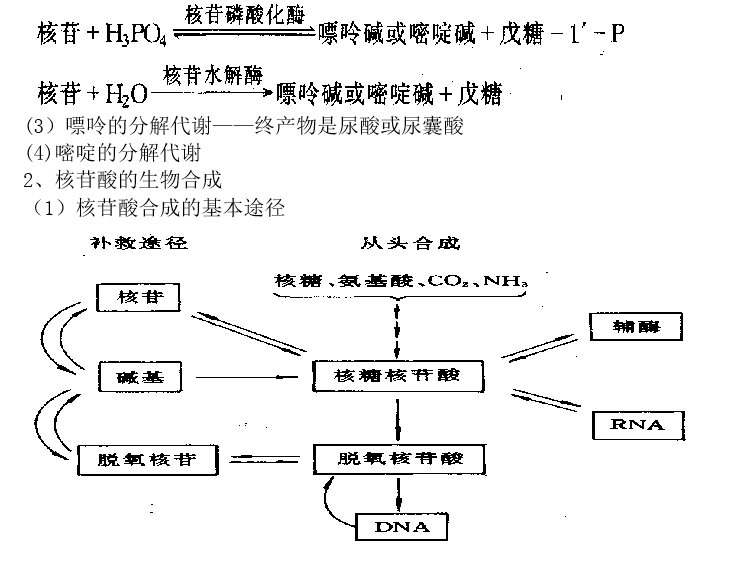
34.1本章知识点串讲
除了少数噬菌体外,从细菌到高等动、植物的DNA分子都是由双螺旋DNA组成。两条多核苷酸链的走向相反,沿着螺旋看,一条链的走向由5’端到3’端,而另一条链则由3’端到5’端。较高等的生物的DNA分子十分巨大,例如人的基因组由23对染色体组成,分别来自双亲的每个染色单体就是一个DNA分子。如果不考虑细胞器内的遗传信息,人类所有的遗传信息都编码在这23个DNA大分子上,共有3*109个碱基对。DNA分子的忠实而准确的复制和修复机制保证了它作为遗传信息载体不可替代的地位。
DNA是遗传的物质基础。细胞分裂时,通过DNA的复制,遗传信息从亲代DNA分子传到子代DNA分子中。另一方面,DNA分子储藏的信息要通过指导特异蛋白质的合成来体现其生物学功能。将DNA的遗传信息传递给mRNA的过程称为转录,以mRNA为模板,决定蛋白质合成的过程称为翻译。经过转录和翻译,遗传信息从DNA传递到蛋白质,这种遗传信息传递的规律,又称作遗传信息传递的中心法则。
1、DNA的复制
(1)DNA的半保留复制:(见教材p407)
A 、DNA分子复制的一般特点
DNA分子的复制是从特定的位点开始并按特定的方向进行。
一般而言,DNA分子在复制时并不是随机起始的,而是从特定的位点开始。这个特定的位点就叫做复制起始点。在复制起始点处双链DNA解旋,形成所谓的复制叉。在复制叉处新合成的子链DNA以各自的亲链为模板,总是按5’端到3’端的方向进行合成。现在已知一个大肠杆菌复制起始点由大约245个碱基对组成;从酵母基因组中分离出的复制起始点又叫做自主复制序列,是一个由 11个碱基对组成的共有序列,此序列几乎完全由AT碱基对组成,而第一个和最后一个AT碱基对的方向可能是相反的。
原核生物双向或单向都可以进行复制。
真核生物有多个起始位点。
B、DNA分子的半保留复制
DNA分子的双螺旋在复制时分开,各自作为新链合成时的模板。复制后,每一个新的双链DNA分子都是由一条亲链和一条新合成的子链组成的。合成过程中亲链和子链间严格的碱基配对是 DNA复制的基础。
C、DNA分子的半不连续合成
DNA分子在复制过程中,复制叉是不对称的。两条新合成的链中,一条是连续合成的,叫做前导链;另一条是在模板DNA的指导下,通过一种叫做DNA引发酶的蛋白质,在特定的间隔区先合成大约10个核苷酸组成的RNA引物为RNA聚合酶提供 3’- OH,然后合成一个称之为冈崎片段的不连续的 DNA片段,最后通过专门的DNA修复系统,快速去除RNA引物而代之以DNA,再经DNA连接酶通过3’ 、5’ –磷酸二酯键将其连接起来,完成此子链的合成,这一条链叫做后随链。
在DNA复制过程中,一条链是连续合成的,而另一条链是不连续合成。因体内仅含催化5'→3'合成的DNA聚合酶。60年代冈琦片段的发现解决了这个问题:
合成5'→3'前导链(leading strand)是连续的,合成方向与复制叉一致。
合成3'→5'随从链时,合成方向与复制叉相反,合成不连续,最终各片段连成一条链。
D、复制过程和参与的酶及因子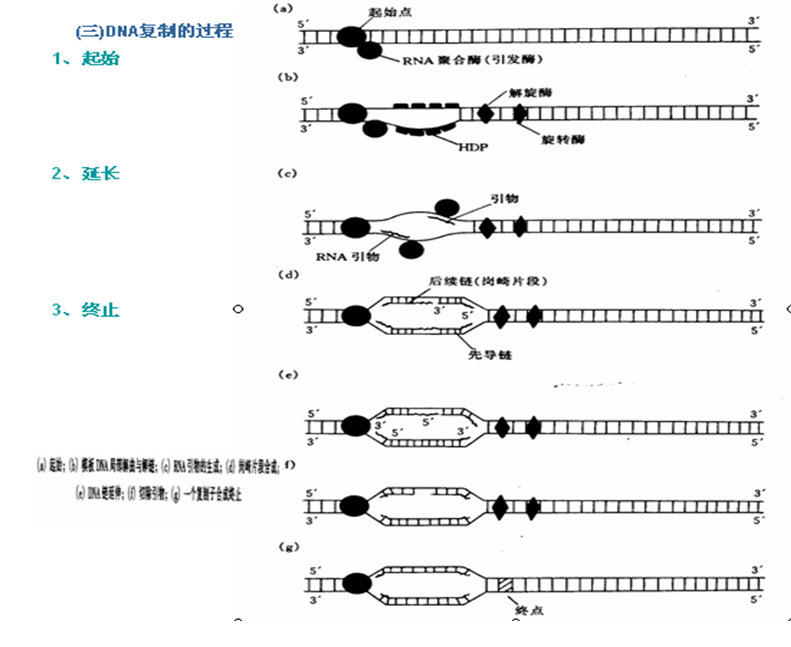
E、真核生物复制的特点
a.复制速度:是原核的1/10,但复制起始点多。
b.引物和冈琦片段小于原核,引物为10个核苷酸,片段100-200个核苷酸;原核引物十几-几十,片段1000-2000个核苷酸。
c.复制需DNA pol及多种因子参加,polα和polδ在核内起主要作用。
d.polγ为线粒体复制酶。
e.DNA复制位于细胞周期的S期。
2、DNA的损伤修复
造成DNA损伤的原因:物理、化学、生物因素。
细胞对DNA的损伤修复系统有5种:错配修复、直接修复、切除修复、重组修复和易错修复。(见教材p428)
3、DNA的突变
(1)突变的类型
A、碱基对的置换
转换
颠换
错义突变
无义突变
B 、移码突变
(2)诱变剂的作用
碱基类似物
碱基的修饰剂
嵌入燃料
紫外线和紫外线和电离辐射
34.2本章重难点总结
1、DNA复制的特点
2、DNA复制的过程
35.1本章知识点串讲
1、同源重组(了解 见教材p440)
(1)概念:同源重组又称为一般性重组,它是由两条同源区的DNA分子,通过配对、链的断裂和再连接,而产生片段交换的过程。
2、特异位点重组(了解 见教材p443)
3、转座重组(见教材p447)
转座因子是一种可以由染色体的一个位置转移到另外位置的遗传因子。也就是一段可以发生转座的DNA,又称为转座子。
(1)细菌的转座因子
(2)真核生物的转座因子
36.1本章知识点串讲
1、DNA指导下的RNA的合成
(1)转录作用及特点
由DNA指导的RNA合成, DNA以碱基互补原则,决定合成RNA的全部碱基成分及排列顺序,将DNA模板上的遗传信息传递到RNA分子的过程为转录作用。
A、反应体系:DNA模板,NTP,酶,Mg2+,Mn2+,合成方向5'→3'。连接方式-- 3' , 5'磷酸二酯键。
B、转录特点:不对称转录--DNA片段转录时,双链DNA中只有一条链作为转录的模板,这种转录方式称作不对称转录。
模板链及反意义链:指导RNA合成的DNA链为模板链,又称反意义链。
编码链及有意义链:不作为转录的另一条DNA链为编码链,又称有意义链。由于基因分布于不同的DNA单链中,即某条DNA单链对某个基因是模板链,而对另一个基因则是编码链。
C 、原料:四种磷酸核苷NTP,DNA中的T在RNA合成中变为U
(2)RNA聚合酶. (见教材p456)
A原核生物:5个亚基 α、β、β’.、σ、 ω
B真核生物:酶I:rRNA
酶II:mRNA
酶III:tRNA
(3) RNA的生物合成过程
A、起始阶段: 转录在启动子调控下起始,E.coli RNA聚合酶结合到模板上的启动子后,就开始了RNA的合成。细菌启动子要行使其功能需要两个高度保守DNA序列,一个序列区是处于开始转录的第一个核苷酸的5ˊ端之前(习惯称之上游)的35个核苷酸,上游的核苷酸编号为"-",所以35个核苷酸区又称之-35区。另一个保守区称之-10区,即转录起始点上游的10个核苷酸。给出了来自噬菌体和细菌的10个基因的启动子序列,这些启动子都可被RNA聚合酶中的s70亚基(E.coli中最常见的一种s亚基)识别。
B、延长阶段: 转录泡:是由DNA双链,RNA聚合酶与新合成的转录本RNA局部形成的结构,它贯穿于延长过程的始终。
过程:在起始阶段形成第一个磷酸二酯键后,RNA聚合酶核心酶沿模板向下游移动,核苷酸之间以3',5'磷酸二酯键相连,合成方向5'→3',合成的RNA自3'末端逐步延长。合成出的RNA与DNA形成杂交分子,约12bp,因结合不紧很易脱离。
C、终止阶段: 合成移到终止信号时,酶不滑动,聚合停止,转录完成。
特点:ρ因子参与的终止:r因子与RNA产物中富含C的部位结合,并诱使RNA聚合酶构象改变停止滑动; ρ因子的解螺旋酶活性,利于RNA产物的释放。
其它终止方式:GC区形成的发卡结构阻碍RNA聚合酶的行进,聚U区使配对不稳定,以利于 RNA产物的释放。
(4)启动子和转录因子 (见教材p459)
A 、启动子是指RNA聚合酶识别、结合和开始转录的一段DNA序列。
—10序列
—35序列
B、 真核生物的启动子有三类 (见教材p460)
(5)终止子和终止因子
提供转录停止信号的DNA序列称为终止子。
2、RNA的转录后加工:
(1)原核生物中RNA的加工(了解 见教材p473)
(2)真核生物中RNA的一般加工 (了解 见教材p475)
(3)RNA的拼接、剪辑和再编码
RNA编码序列的改变成为编辑。RNA编辑和读码方式的改变称为再编码。
A 、RNA拼接共有4种方式:(见教材 p478)
B、RNA拼接的生物学意义 (见教材 p485)
3、在RNA指导下RNA和DNA的合成
(1)RNA的复制
RNA复制酶无校对功能,它只是特异地对病毒的RNA起作用,而宿主细胞的RNA一般不复制。
(2)RNA的逆转录
A 以RNA为模板、即按照RNA中的核苷酸顺序合成DNA,这与通常转录过程中遗传信息流从DNA到RNA的方向相反,故称逆转录。
B 逆转录的生物学意义(见教材 p497)
(3)逆转座子的种类和作用机制(了解 见教材p498)
36.2本章重难点总结
1、RNA的生物合成
2、启动子的含义及相关概念
37.1本章知识点串讲
遗传密码:指核苷酸三联体决定氨基酸的对应关系。
1、DNA是遗传信息的携带分子(了解 见教材p504)
2、RNA传递和加工遗传信息
RNA的信息加工是指RNA在传递遗传信息过程中进行抽提信息、转换信号、消除差错、调节信息流等作用。
(1)RNA的拼接
真核生物的基因都是断裂基因,保留在成熟RNA中的序列称为外显子,插入的非编码序列称为内含子。通过选择性拼接,一个基因可以编码多条多肽链,这些多肽链称为同源体。
拼接的生物学意义:它是基因表达调节的重要环节,并且是产生新的基因和新的蛋白质的基础。
(2)RNA的编辑
RNA编辑可消除基因移码突变或无义突变带来的危害,通过编辑恢复正确的阅读框架。
(3)RNA的译码和再编码
译码是RNA信息加工最重要最核心的作用。
基因突变造成密码子的改变称为错义突变。
基因突变使有义密码子变成终止密码子,称为无义突变。
3、遗传密码的破译(了解 见教材p508)
4、遗传密码的基本特性
(1)密码的基本单位:按5’-3’方向编码、不重叠、无标点的三联体密码子。
起始密码子:AUG
终止密码子:UAA、UAG、UGA
(2)密码的简并性
同一种氨基酸有两个或更多密码子的现象,称为密码子的简并性。
对应于同一种氨基酸的不同密码子称为同义密码子。
(3)密码的变偶性
tRNA上的反密码子与mRNA密码子配对时,密码子第一、第二位碱基配对是严格的,第三位碱基可以有一定的变动。Crick称这一现象为变偶性。
(4)密码的通用性和变异性
密码的通用性是指各种低等和高等生物,包括病毒、细菌及真核生物,基本上共用一套遗传密码。
37.2本章重难点总结
RNA传递和加工遗传信息
38.1本章知识点串讲
1、蛋白质合成的分子基础(见教材 p519)
(1)mRNA是蛋白质合成的模板
(2)tRNA转运活化的氨基酸到mRNA模板上
(3)核糖体是合成蛋白质的工厂
2、翻译的步骤(见教材 p525)
(1)氨酰-tRNA合成酶帮助使氨基酸结合到特定的tRNA上
(2)每一个氨酰-tRNA合成酶可识别一个特定的氨基酸和与此氨基酸对应的tRNA的特定部位。
(3)氨酰-tRNA合成酶能够纠正酰化的错误
(4)一个特殊的tRNA启动了蛋白质的合成
(5)翻译起始于mRNA与核糖体的结合
(6)蛋白质因子帮助蛋白质合成起始
(7)在氨基酸的掺入过程中有三个重复的延伸反应
(8)核糖体反应中GTP的作用
(9)翻译的终止需要释放因子和终止密码子的参加
(10)核糖体在翻译中能跳跃式读码
3、蛋白质的运输及翻译后修饰
(1)蛋白质通过信号肽引导到目的地
每一需要运输的多肽都含有一段氨基酸序列,称为信号肽序列。
(2)简要了解其他内容
38.2本章重难点总结
蛋白质合成的简要过程
39.1本章知识点串讲
了解大体知识框架(见教材 p539)
40.1本章知识点串讲
1、克隆基因流程图
2、获取目的基因
(1) 人工化学合成
(2) PCR扩增
(3) DNA文库钓取
(4) 差式筛选
3、真核细胞表达系统
真核细胞作宿主表达系统的优点:
①真核细胞能够识别和除去外源基因中的内含子,剪接加工形成成熟的mRNA。也就是说含有内含子的天然基因在真核细胞中是可以利用的,这是原核细胞办不到的。
②真核细胞将表达的蛋白糖基化,而大肠杆菌表达的蛋白是没有糖基化的,糖基化对某些表达蛋白的免疫原性影响很大。
真核细胞作宿主表达系统存在的问题:
①选择标记及选择系统只有少数几个;
②转化效率低;
③外源基因转移并整合到细胞染色体DNA上带有一定的自发性和盲目性,整合的拷贝数和位置都还不能控制;
④细胞培养及细胞的挑选要求比较高,手续繁琐费时。
细胞大量培养技术性强,而且成本较高,利用培养细胞方式大量生产某些表达蛋白,从工艺到成
本都要很好地考虑。
4、原核细胞表达系统
与真核细胞相比,原核细胞的表达有以下特点:
①只有一种RNA聚合酶识别原核细胞的启动子,催化所有RNA的合成。
②原核生物的表达是以数个相关的结构基因及其调控区的操纵子为单位的。 调控区主要分为:操作子(operator)、启动子(promotor)及其他有调控功能的部位。
③原核生物无核膜,转录与翻译相偶联并连续进行。
原核生物染色体DNA是裸露的环形DNA,转录成mRNA后,可直接在胞浆中与核糖体结合翻译形成蛋白质。在翻译过程中,mRNA可与一定数目的核糖体结合形成多核糖体(polyribosome)。两个核糖体之间有一定长度的间隔,为裸露的mRNA。每个核糖体可独立完成一条肽链的合成,即这种多核糖体可以同时在一条mRNA链上合成多条肽链,大大提高了翻译效率。
④原核基因一般不含有内含子(intron)。
在原核细胞中缺乏真核细胞的转录后加工系统,因此当克隆的含有内含子的真核基因在原核细胞中转录成mRNA前体后,其中内含子部分不能被切除。
⑤原核生物基因的控制主要在转录水平。
这种控制比对基因产物的直接控制要慢。对RNA合成的控制有两种方式,一是起始控制(启动子控制),二是终止控制(衰减子控制)。
⑥ 含有S-D序列。
在大肠杆菌mRNA的核糖体结合位点上,含有一个转译起始密码子及同16S核糖体RNA3′末端碱基互补的序列,即S-D序列,而真核基因则缺乏此序列。
40.2本章重难点总结
基因克隆及表达的过程。
真题重要性概括
首先,真题能够真实反应一个学校考题的难易程度,把握好真题我们就把握准了学校的考试方向,俗话说:“知己知彼,百战不殆”,如果我们了解出题老师的意图,我们就可以有选择、有重点的进行复习。
其次,真题是最好的联系,任何一门考试,考前训练都是必不可少的,我们现在不可能像高考前一样搞大规模的题海战术,那我们应该怎么办?做真题!
再次,我们要通过真题,扩大知识体系,构建知识网络。
3.1.1 2008年真题
【点评】本年份真题包括以下三种题型:名词解释、选择、问答。
和往年考试题目对比,题型变化很小。今后也不会有大的改变。
【题目】名词解释
Restriction Endonuclease:限制性核酸内切酶, 这是一类能从DNA分子中间水解磷酸二酯键,从而切断双链DNA的核酸水解酶。
Anticodon:反密码子, 转移核糖核酸中能与信使核糖核酸的密码子互补配对的三核苷酸残基。位于转移核糖核酸的反密码子环的中部.
One Carbon Unit:一碳单位,仅含一个碳原子的基团。如甲基、甲烯基、甲炔基、甲酰基(甲醛基)及亚胺甲基等,通常与四氢叶酸结合在一些化合物之间转移,且可互相转变。
Coenzyme:辅酶,作为酶的辅因子的有机分子,本身无催化作用,但一般在酶促反应中有传递电子、原子或某些功能基团(如参与氧化还原或运载酰基的基团)的作用。
【题目】
Km:米氏常数,Km值是当酶反应速率达到最大反应速率一半时的底物浓度,单位为mol/L
Central Dogma:中心法则,是1958年由克里克(Crick)提出的遗传信息传递的规律,包括由DNA到DNA的复制、由DNA到RNA的转录和由RNA到蛋白质的翻译等过程。20世纪70年代逆转录酶的发现,表明还有由RNA逆转录形成DNA的机制,是对中心法则的补充和丰富。
Intron:内含子,真核生物细胞DNA中的间插序列。这些序列被转录在前体RNA中,经过剪接被去除,最终不存在于成熟RNA分子中。
Lagging Strand:后滞链,在复制过程中,顺着解链方向生成的子链,复制是连续进行的,这股链称为前导链(领头链),另一股链因为复制的方向与解链方向相反,不能顺着解链方向连续延长,这股不连续复制的链称为后滞链。
【题目】
Reverse Transcription:反转录,以RNA为模板,在反转录酶催化下转录为双链DNA的过程。
Operon:操纵子,一个完整的调节系统包括结构基因和控制这些基因表达的元件,形成了一个共同的调节单位,这种调节单位就称为操纵子(opron)。操纵子的活性是由调节基因控制的,调节基因的产物可以和操纵子上的顺式作用控制元件相互作用。
Direct Repair:直接修复p428 是通过一种可连续扫描DNA,识别出损伤部位的蛋白质将损伤部位直接修复的方法。该修复方法不用切断DNA或切除碱基。
Promoter:启动子,DNA分子上能与RNA聚合酶结合并形成转录起始复合体的区域。在许多情况下,还包括促进这一过程的调节蛋白的结合位点。
【题目】
Gel Filtration Chromatography:凝胶过滤层析(法)使用有一定大小孔隙的凝胶作层析介质(如葡聚糖凝胶、琼脂糖凝胶、聚丙烯酰胺凝胶等),利用凝胶颗粒对分子量和形状不同的物质进行分离的层析技术。由于各种分子的大小、形状不同,扩散到凝胶孔隙内的速度不同,因而通过层析柱的快慢不同而分离。
Tm:DNA的熔点或溶解温度,指加热变性使DNA的双螺旋结构失去一半时的温度
Chemiosomotic Hypothesis:化学渗透假说,1961年英国生物化学家Peter Mitchell最先提出。他认为电子沿电子传递释放出的自由能和ATP合成是与一种跨线粒体内膜的质子梯度相偶联的。也就是,电子传递的自由能驱动H+从线粒体基质跨过内膜进入到膜间隙,从而形成跨线粒体内膜的H+电化学梯度。这个梯度的电化学电势驱动ATP的合成。
【题目】为什么说氨基酸和蛋白质是两性电解质?试分析原因?
答:氨基酸是两性电解质。由于氨基酸含有酸性的羧基和碱性的氨基,所以既是酸又是碱,是两性电解质。有些氨基酸的侧链还含有可解离的基团,其带电状况取决于它们的pK值。由于不同氨基酸所带的可解离基团不同,所以等电点不同。
【题目】试以血红蛋白为例,说明蛋白质的别构效应是如何发生的?(8分)
答:别构效应又称为变构效应,是寡聚蛋白与配基结合改变蛋白质的构象,导致蛋白质生物活性改变的现象. 别构效应(allosteric effect)某种不直接涉及蛋白质活性的物质,结合于蛋白质活性部位以外的其他部位(别构部位),引起蛋白质分子的构象变化,而导致蛋白质活性改变的现象。
别构效应在生命活动调节中起很重要作用。如阻遏蛋白受小分子物质的影响发生构象变化,改变了它与DNA结合的牢固程度,从而对遗传信息的表达进行调控。另如激素受体,神经递质受体等都是通过生物分子的影响发生构象变化而传递信息的。可以说别构效应是生物分子“通讯”的基础。
别构蛋白质——血红蛋白
【题目】
它的别构效应表现在:①氧结合的正协同性,氧饱和曲线与氧分压的关系呈S型曲线,表明在第1个亚基与O2结合后其他亚基与O2的相继结合越来越容易,第4个亚基的氧结合常数可比第1个的大数百倍。这是因为第1个亚基结合O2后引起血红蛋白分子的构象变化,促使其他亚基与O2结合。O2的释放过程也是如此,第1个O2释放使留下的O2更易释放。②H+浓度升高(pH降低)使血红蛋白与 O2的亲和力变小(玻尔效应),促进O2的释放。③在恒定pH下CO2能降低血红蛋白与O2的亲和力。④人红细胞中含有的2、3二磷酸甘油酸(DPG),也能降低O2的亲和力。⑤血红蛋白与O2的结合也能抑制其与H+,CO2和DPG的结合。
别构酶处于两种构象状态,即紧张态(T态)和松弛态(R态),T态与底物的亲和力低,R态与底物的亲和力高。X射线衍射分析证明了脱氧血红蛋白Hb和氧合血红蛋白HbO2在构象上的差异。Hb4个亚基(α2β2)之间至少有8对盐桥相联系,紧张态(T态)时O2的结合受到障碍,而在氧结合时这些盐桥被逐步破坏,生成的HbO2结构松散,属于R态,易与O2结合。这就是氧合时协同效应。
【题目】
血红蛋白氧合时构象变化的要点如下:血红素中的铁与O2结合时随即进入卟啉环平面内,将邻近的原来倾斜的组氨酸F8拉直,并带动附近肽链的运动,结果导致αβ亚基相对于另一对αβ亚基转动15°角(。如果将 4个亚基标记为α1。α2,β1和β2,则α2β2之间和G沙之间两个接触面较牢固,没有改变,变动最大的是α1β2(或α2β1)之间的接触面,α1β2(α2β1)界面的变动是T态向R态转变的开关(反之亦然)。在T态向R态转变时,盐桥破坏,当O2释放时,又通过该界面的滑动,盐桥重新恢复,R态又能转变成T态。α1β2(α2β1)界面的氨基酸序列是相当保守的,如在这一序列范围内发生突变则对别构效应有较大影响。
【题目】简述天然DNA二级和三级结构的特点,并分析DNA的结构如何与其生物学功能相适应。
DNA二级结构的特点与生物学功能:
DNA分子双螺旋结构的主要特点:
DNA分子是有2条链组成,反向平行盘旋成 双螺旋结构。脱氧核糖和磷酸交替连接,排列在外侧,构成基本骨架;碱基对排列在内侧。碱基通过 氢键连接成碱基对,并遵循碱基互补配对原则。
DNA的双螺旋结构,DNA具有特殊的空间结构:
1)DNA分子是由两条平行的脱氧核苷酸长链盘旋而成的;
2)DNA分子中的脱氧核糖和磷酸交替联结,排列在外侧,构成了基本骨架;碱基在内侧;导致了DNA分子结构的不对称性,所以DNA分子是有极性的,即两条链反向平行排列。
3)内侧:两条链上的碱基通过氢键联结起来,形成碱基对——维持双螺旋结构稳定
DNA双螺旋结构中碱基对的组成是有一定的规律的:配对的严格专一性
4)DNA双螺旋结构的多态性
A-DNA B-DNA Z-DNA H-DNA(三螺旋核酸)
【题目】
DNA双螺旋的稳定性:
1)DNA双螺旋结构在生理条件下是很稳定的。
2)维持这种稳定性的因素包括:两条DNA链之间形成的氢键;
3)由于双螺旋结构内部形成的疏水区,消除了介质中水分子对碱基之间氢键的影响;介质中的阳离子(如Na+、K+和Mg2+)中和了磷酸基团的负电荷,降低了DNA链之间的排斥力、范德华引力等
4) 改变介质条件和环境温度,将影响双螺旋的稳定性。
DNA的其它螺旋结构
回文结构:DNA序列中以某一中心区域为对称轴,其两侧的碱基对顺序正读和反读都相同的双螺旋结构。 即对称轴一侧的片段旋转180°后,与另一侧片段对称重复。 回文结构能形成十字结构和发夹结构
镜像重复:存在于同一股上的某些DNA区段的反向重复序列。此序列各单股中没有互补序列,不能形成十字型或发夹结构。
【题目】
DNA三股螺旋(H-DNA):DNA三股螺旋构型称为H-DNA,它是双螺旋DNA分子中一条链的某一节段, 通过链的折叠与同一分子中DNA结合而形成。其中一条链只有嘌呤AG,另一条链只有嘧啶CT,并具有镜像重复,这种结构在形成分子内三股螺旋时胞嘧啶需发生H+化过程,故称为H-DNA。通过DNA单链之间形成氢键实现的
H-DNA可在转录水平上阻止基因的转录
DNA的三级结构与生物学功能:
双螺旋进一步扭曲形成的超螺旋。是一种比双螺旋更高层次的空间构象。包括:线状DNA形成的纽结、超螺旋和多重螺旋、环状DNA形成的结、超螺旋和连环等
DNA三螺旋结构的特点
(1)组成三螺旋的DNA单链,一般都是由单一的嘌呤碱基(A和G)或单一的嘧啶碱基(C和T)所组成。
(2)DNA三螺旋的基本结构有两种,一种是由两条多聚嘧啶碱基核苷酸链和一条多聚嘌呤 碱基核苷酸链组成,即嘧啶-嘌呤-嘧啶。三条链中碱基形成氢键的情况是:T-A-T ,C-G-C。第二种是由两条多聚嘌呤碱基核苷酸链和一条多聚嘧啶碱基核苷酸链组成,简单表示为嘌呤-嘌呤-嘧啶。三条链中碱基形成氢键的情况是:A-A-T,G-G-C。上述两种结构中,中间的碱基必须是嘌呤碱基。
(3)每一条单链至少由8个核苷酸组成
功能:(1)控制基因转录 (2)保护靶序列防止酶切
【题目】以原核生物为例,说明蛋白质合成的分子机制。(10分)
答:原核生物的蛋白质生物合成 氨基酸在核糖体上缩合成多肽链是通过核糖体循环而实现的。此循环可分为肽链合成的起始(intiation),肽链的延伸(elongation)和肽链合成的终止(termination)三个主要过程。原核细胞的蛋白质合成过程以E.coli细胞为例。(一)氨基酸的活化转运氨基酸的活化过程及其活化后与相应 tRNA的结合过程,都是由氨基酰tRNA合成酶来催化的,反应方程为:tRNA+氨基酸+ATP〖FY(KN〗氨基酰tRNA合成酶〖FY)〗氨基酰-tRNA+AMP+焦磷酸。以氨基酰tRNA形式存在的活化氨基酸,即可投入氨基酸缩合成肽的过程。氨基酰tRNA合成酶存在于胞液中,具有高度特异性。它们既能识别特异的氨基酸,又能辨认携带该种氨基酸的特异tRNA分子。在体内,每种氨基酰tRNA合成酶都能从多种氨基酸中选出与其对应的一种,并选出与此氨基酸相应的特异tRNA。这是保证遗传信息准确翻译的要点之一。
【题目】
(二)核蛋白提循环 tRNA所携带的氨基酸,是通过“核蛋白体循环”在核蛋白体上缩合成肽,完成翻译过程。原核生物中蛋白质合成为例,将核蛋白体循环人为地分为启动、肽链延长和终止三个阶段进行介绍。1.启动阶段在蛋白质生物合成的启动阶段,核蛋白体的大、小亚基,mRNA与一种具有启动作用的氨基酸tRNA共同构成启动复合体。这一过程需要一些称为启动因子的蛋白质以及GTP与镁离子的参与。 原核生物中的启动因子有 3种,IF 1辅助另外两种启动因子IF 2、IF 3起作用。
启动阶段的具体步骤如下:
(1)30S亚基在IF 3与IF 1的促进下与mRNA的启动部位结合,在IF 2的促进与IF 1辅助下与甲酰蛋氨酰tRNA以及GTP结合,形成30S启动复合体。30S启动复合体由30S亚基、mRNA、fMet-tRNA fMet及IF 1、IF 2、IF 3与GTP共同构成。
(2)30S启动复合体一经形成,IF 3即行脱落,50S亚基随之与其结合,形成了大、小亚基,mRNA,fMet-tRNA fMet及IF 1、IF 2与GTP共同构成的70S启动前复合体。
( 3)70S启动前复合体的GTP水解释出GDP与无机磷酸的同时,IF 2和IF 1随之脱落,形成了启动复合体。至此,已为肽链延长作好了准备。
启动复合体由大、小亚基, mRNA与fMet-tRNA fMet共同构成。已知核蛋白体上有两个位置,分别称为“给位”与“受位”,启动复合体中 mRNA的启动信号相对应的fMet-tRNA fMet亦即处于核蛋白体的给位。
2.肽链延长阶段
这一阶段,根据 mRNA上密码子的要求,新的氨基酸不断相应的被特异的tRNA运至核蛋白体受位,形成肽键。同时,核蛋白体从mRNA的5′端向3′端不断移位推进翻译过程。肽链延长阶段需要数种称为延长因子的蛋白质、GTP与某些无机离子的参与。
【题目】
(1)进位
受位上 mRNA密码子相对应的氨基酸tRNA进入受位,生成复合体V。此步骤需要GTP、Mg2+和称为肽链延长因子EFTu与EFTs的蛋白质因子。
(2)转肽
50S亚基的给位有转肽酶的存在,可催化肽键形成。此时在转肽酶的催化下,将给位上tRNA所携的甲酰蛋氨酰(或肽酰)转移给受位上已特异性进入的氨基酸tRNA,与其所带的氨基酸的氨基结合形成肽键。此酶需要Mg 2+与K 2+存在。
(3)脱落
原在给位上的脱去甲酰蛋氨酰后的 tRNA fMet,从复合物上脱落。
(4)移位
【题目】
核蛋白体向 mRNA的3′端挪动相当于一个密码子的距离,使下一个密码子准确定位在受位,同时带有肽链的tRNA由受体移至给位,此步需有肽链延长因子EFG、GTP与Mg 2+。 以后肽链上每增加一个氨基酸残基,就按①进位(新的氨基酸tRNA进入“受位”)②转肽(形成新的肽键)③脱落(转肽后“给位”上的tRNA脱落)④移位(核蛋白体挪动的同时,原处于“受位”带有肽链的tRNA随之转到“给位”)。
3.终止阶段
当多肽链合成已完成,并且“受位”上已出现终止信号(UAA),此后即转入终止阶段。终止阶段包括已合成完毕的肽链被水解释放,以及核蛋白体与tRNA从mRNA上脱落的过程。这一阶段需要一种起终止作用的蛋白质因子——终止因子的参与。
终止因子使大亚基“给位”的转肽酶不起转肽作用,而起水解作用。在转肽酶的作用下,“给位”上tRNA所携带的多肽链与tRNA之间的酯键被水解,并从核蛋白体及tRNA上释出。
从mRNA上脱落的核蛋白体,分解为大小两个亚基,重新进入核蛋白体循环。核蛋白体的解体需要IF 3的参与。
【题目】在DNA复制和基因表达中,怎样避免遗传信息的传递出现差错?
答:在DNA复制和基因表达中,通过以下方式避免遗传信息的传递出现差错:
一、DNA的分子结构特点:
(1)在DNA分子中,两股DNA链围绕一假想的共同轴心形成一右手螺旋结构,双螺旋的螺距为3.4nm,直径为2.0nm。
(2)链的骨架(backbone)由交替出现的、亲水的脱氧核糖基和磷酸基构成,位于双螺旋的外侧。
(3)碱基位于双螺旋的内侧,两股链中的嘌呤和嘧啶碱基以其疏水的、近于平面的环形结构彼此密切相近,平面与双螺旋的长轴相垂直。一股链中的嘌呤碱基与另一股链中位于同一平面的嘧啶碱基之间以氢链相连,称为碱基互补配对或碱基配对(base pairing),碱基对层间的距离为0.34nm。碱基互补配对总是出现于腺嘌呤与胸腺嘧啶之间(A=T),形成两个氢键;或者出现于鸟嘌呤与胞嘧啶之间(G=C),形成三个氢键。
(4)DNA双螺旋中的两股链走向是反平行的,一股链是5′→3′走向,另一股链是3′→5′走向。两股链之间在空间上形成一条大沟(major groove)和一条小沟(minor groove),这是蛋白质识别DNA的碱基序列,与其发生相互作用的基础。
DNA双螺旋的稳定由互补碱基对之间的氢键和碱基对层间的堆积力(basestacking force)维系。DNA双螺旋中两股链中碱基互补的特点,逻辑地预示了DNA复制过程是先将DNA分子中的两股链分离开,然后以每一股链为模板(亲本),通过碱基互补原则合成相应的互补链(复本),形成两个完全相同的DNA分子。因为复制得到的每对链中只有一条是亲链,即保留了一半亲链,将这种复制方式称为DNA的半保留复制(semiconservative replication)。后来证明,半保留复制是生物体遗传信息传递的最基本方式。 DNA双螺旋是核酸二级结构的重要形式。双螺旋结构理论支配了近代核酸结构功能的研究和发展,是生命科学发展史上的杰出贡献。
【题目】
二、生物个体内存在DNA损伤修复系统
1.直接修复(direct repair)
是通过一种可连续扫描DNA,识别出损伤部位的蛋白质,将损伤部位直接修复的方法。该修复方法不用切断DNA或切除碱基。
一些蛋白质可以识别和修复某种损伤的核苷酸和错配的碱基,这些蛋白可以连续监测DNA。胸腺嘧啶二聚体就可以通过直接修复机制修复。胸腺嘧啶二聚体是紫外线辐射造成的。在所有原核生物和真核生物中都存在一种光激活酶(photoreactivating enzyme),在可见光存在下,这种酶可以结合胸腺嘧啶二聚体引起的扭曲双螺旋部位,催化两个胸腺嘧啶碱基再生,正常的A-T碱基对重新形成,然后光复活酶从已修复好的DNA上脱落。
2.核苷酸切除修复(excision repair)
通过切除-修复内切酶使DNA损伤消除的修复方法。一般是切除损伤区,然后在DNA聚合酶的作用下,以露出的单链为模板合成新的互补链,最后用连接酶将缺口连接起来。
形成胸腺嘧啶二聚体会引起DNA双螺旋结构的变形,这样的损伤也可以通过核苷酸切除系统修复。修复系统中的主要酶ABC切除核酸酶。给出了ABC切除核酸酶修复DNA损伤的过程。首先ABC切除核酸酶从损伤部位的两侧切去含有损伤的DNA链。然后,解旋酶除去内切酶切点之间的DNA片段,有时DNA片段由外切酶降解,产生单链缺口。然后在DNA聚合酶的催化下按照互补链填充缺口,切口最后通过DNA连接酶连接。
3.碱基切除修复DNA
糖基化酶(DNA glycosylases)能识别DNA中的不正确碱基,如尿嘧啶、次黄嘌呤和黄嘌呤,这些碱基是由胞嘧啶、腺嘌呤和鸟嘌呤脱氨形成的。DNA糖基化酶可以切断这种碱基N-糖苷键,将其除去,形成的脱嘌呤或脱嘧啶部位通常称为"abasic"部位或AP位点。然后由AP内切核酸酶(AP endonucleases)切去含有AP位点的脱氧核糖-5-磷酸,在DNA聚合酶作用下重新放置一个正确的核苷酸,最后通过DNA连接酶将切口封闭。每种DNA糖基化酶通常对一种类型的碱基损伤特异。
【题目】
4.错配修复(mismatch repair)
在含有错配碱基的DNA分子中,使正常核苷酸序列恢复的修复方式。这种修复方式的过程是:识别出下正确地链,切除掉不正确链的部分,然后通过DNA聚合酶和DNA连接酶的作用,合成正确配对的双链DNA。
错误的DNA复制会导致新合成的链与模板链之间的产生错误的碱基配对。这样的错误可以通过E.coli中的3个蛋白质(MutS、MutH和MutL)校正。该修复系统只校正新合成的DNA,因为新合成DNA链的GATC序列中的A(腺苷酸残基)开始未被甲基化。GATC中A甲基化与否常用来区别新合成的链(未甲基化)和模板链(甲基化)。这一区别很重要,因为修复酶需要识别两个核苷酸残基中的哪一个是错配的,否则如果将正确的核苷酸除去就会导致突变。(右图)说明了MutS、MutH和MutL三种蛋白质是如何校正新合成DNA中的一个错配错误的。未甲基化的GATC序列不需要紧靠着错配碱基,因为错配碱基与GATC序列之间的间隔的DNA序列可以被外切核酸酶切除,是从3ˊ还是从5ˊ方向切除取决于不正确碱基的相对位置。
3.1.2 2009年真题
【题目】名词解释
domain:结构域 多肽链在二级结构的基础上形成三级结构的局部折叠区,它是相对独立的紧密球状实体,成为结构域。
exon:外显子 基因组DNA中出现在成熟RNA分子上的序列。外显子被内含子隔开,转录后经过加工被连接在一起,生成成熟的RNA分子。信使核糖核酸(mRNA)所携带的信息参与指定蛋白质产物的氨基酸排列。
Southern blotting:Southern于1975年首先建立从琼脂糖凝胶电泳中分离的DNA转至纤维膜上,再与特定的带有放射性同位素标记的DNA(或RNA)片断杂交,最后经过放射自显影等方法从X光底片上显现一条或多杂交分子区带,从而达到检测特定DNA片断的方法,后来把这种方法称为Southern Blotting(Southern印迹)
two dimensional electrophoresis:双向电泳是等电聚焦电泳和SDS-PAGE的组合,即先进行等电聚焦电泳(按照pI分离),然后再进行SDS-PAGE(按照分子大小)。
active center:活性中心,一些氨基酸残基比较集中的区域,与酶活力直接相关的区域成为酶的活性中心。
telomere:端粒是指真核生物染色体线性DNA分子末端的结构部分,通常膨大成粒状。其共同的结构特征是由一些富含GC的短重复序列构成,可重复数十次至数百次。
melting temperature:DNA的熔点或溶解温度,指加热变性使DNA的双螺旋结构失去一半时的温度。
ethanol fermentation:乙醇发酵 指在无氧条件下 将糖类转化为乙醇和CO2的过程。
ATP synthase:ATP合成酶广泛分布于线粒体内膜,叶绿体类囊体,异养菌和光合菌的质膜上,参与氧化磷酸化和光合磷酸化,在跨膜质子动力势的推动下合成ATP。
gluconeogenesis:葡萄糖异生作用是指生物体利用非糖前体物(如乳酸、氨基酸、甘油等)合成葡萄糖和糖原的过程。
urea cycle:尿素循环动物氮代谢最终产物——尿素的生成过程,是一个由4步酶促反应组成的,可以将来自氨和天冬氨酸的氮转化为尿素的循环。
replisome:复制体,在DNA合成的生长点即复制叉上,分布着各种各样与复制有关的酶和蛋白质因子,它们构成的复合体叫复制体。
transcriptional factor:转录因子,能够结合在某基因上游特异核苷酸序列上的蛋白质,活化后从胞质转位至胞核,通过识别和结合基因启动子区的顺式作用元件,启动和调控基因表达。
signal peptide:信号肽,分泌蛋白新生肽链N端的一段20~30氨基酸残基组成的肽段。将分泌蛋白引导进入内质网,同时这个肽段被切除。现这一概念已扩大到决定新生肽链在细胞中的定位或决定某些氨基酸残基修饰的一些肽段。
open reading frame:开放阅读框,是结构基因的正常核苷酸序列,从起始密码子到终止密码子的阅读框可编码完整的多肽链,其间不存在使翻译中断的终止密码子。
【题目】简答题
试分析DNA双螺旋结构的特点及蕴含的生物学意义。(6分)
答:DNA分子双螺旋结构的主要特点:
DNA分子是有2条链组成,反向平行盘旋成 双螺旋结构。脱氧核糖和磷酸交替连接,排列在外侧,构成基本骨架;碱基对排列在内侧。碱基通过 氢键连接成碱基对,并遵循碱基互补配对原则。
DNA的双螺旋结构,DNA具有特殊的空间结构:
1)DNA分子是由两条平行的脱氧核苷酸长链盘旋而成的;
2)DNA分子中的脱氧核糖和磷酸交替联结,排列在外侧,构成了基本骨架;碱基在内侧;导致了DNA分子结构的不对称性,所以DNA分子是有极性的,即两条链反向平行排列。
3)内侧:两条链上的碱基通过氢键联结起来,形成碱基对——维持双螺旋结构稳定
DNA双螺旋结构中碱基对的组成是有一定的规律的:配对的严格专一性
4)DNA双螺旋结构的多态性
A-DNA B-DNA Z-DNA H-DNA(三螺旋核酸)
【题目】
DNA双螺旋的稳定性:
1)DNA双螺旋结构在生理条件下是很稳定的。
2)维持这种稳定性的因素包括:两条DNA链之间形成的氢键;
3)由于双螺旋结构内部形成的疏水区,消除了介质中水分子对碱基之间氢键的影响;介质中的阳离子(如Na+、K+和Mg2+)中和了磷酸基团的负电荷,降低了DNA链之间的排斥力、范德华引力等
4) 改变介质条件和环境温度,将影响双螺旋的稳定性。
双螺旋模型的意义
双螺旋模型的意义,不仅意味着探明了DNA分子的结构,更重要的是它还提示了DNA的复制机制:由于腺膘呤(C)总是与胸腺嘧啶(T)配对、鸟膘呤(G)总是与胞嘧啶(A)配对,这说明两条链的碱基顺序是彼此互补的,只要确定了其中一条链的碱基顺序,另一条链的碱基顺序也就确定了。因此,只需以其中的一条链为模版,即可合成复制出另一条链。
【题目】在酶活力测定中,如何保证测定的是酶反应初速度?(6分)
答:酶活力大小,不是要去表示酶催化效率的高低的。它是酶含量的一个单位。是因为在检查酶是否存在及含量的时候,不能直接用重量或者体积来衡量,通常是用催化某一化学烦赢得能力来表示,就是用酶活力大小表示。酶促反应中,产物的生成量对反应时间的图形,它是一条类似 “s” 型的曲线。曲线的斜率表示单位时间内产物生成量的变化,所以曲线上任何一点的斜率就是该相应时间的反应速率。可以看出,在反应开始的一段时间内,斜率几乎不变,也就是你说的初始速度是不变的。随着时间的延长,曲线逐渐平坦,斜率降低,反应速度也就降低,显然这个时候测得的酶活力不能代表真实的酶活力。 引起酶促反应速率随时间延长而降低的原因很多,如底物浓度降低,产物浓度增加加速了逆反应进行,产物对酶的抑制等等。因此,测定酶活力,应该测定酶促反应的出速率,从而避免上述种种复杂因素对反应速率的影响。最后,酶量和反应初速率呈线性关系,所以可以用初速率来测定制剂中的酶含量。
【题目】
底物浓度如何影响调节酶和非调节酶的酶促反应速率,请图解说明,并分析这种差异产生的原因。(8分)
答:一般被称为调节酶的,主要是指别构酶和共价调节酶。别构酶的初速度-底物浓度曲线为S型,不同于米氏酶。 前期:
当酶与底物反应时程平缓上升趋势,在反应中产生代谢物!
中期:
由于,反应中产生的代谢物少量的话对酶的活性其促进作用,所以反应加快!!
过一段时间之后,代谢物增多,对酶的活性起着抑制性作用,反应变慢!
后期:
由于,代谢物不断的增多,对酶的抑制性越来越强,致使酶的活性减低,因此,反应逐步趋于平缓,呈“s”型曲线!
【题目】
底物对酶促反应的饱和现象:由实验观察到,在酶浓度不变时,不同的底物浓度与反应速度的关系为一矩形双曲线,即当底物浓度较低时,反应速度的增加与底物浓度的增加成正比(一级反应);此后,随底物浓度的增加,反应速度的增加量逐渐减少(混合级反应);最后,当底物浓度增加到一定量时,反应速度达到一最大值,不再随底物浓度的增加而增加(零级反应)。 别构酶(allosteric enzyme)一种其活性受到结合在活性部位以外部位的其它分子调节的酶。又称为变构酶,是一类重要的调节酶。在代谢反应中催化第一步反应的酶或交叉处反应的酶多为别构酶。别构酶均受代谢终产物的反馈抑制。
别构酶多为寡聚酶,含有两个或多个亚基。其分子中包括两个中心:一个是与底物结合、催化底物反应的活性中心;另一个是与调节物结合、调节反应速度的别构中心。两个中心可能位于同一亚基上,也可能位于不同亚基上。在后一种情况中,存在别构中心的亚基称为调节亚基。别构酶是通过酶分子本身构象变化来改变酶的活性。
【题目】
在肝脏中,下列化合物彻底氧化分解为CO2和水,可生成多少ATP?(12分)
(假设NADH和FDH2分别以3ATP和2ATP计算)
(A)甘油 (B)草酰乙酸 (C)乳酸
甘油在甘油激酶(只存在于肝肾肠)催化(消耗1个ATP)下生成3-磷酸甘油,3-磷酸甘油在磷酸甘油脱氢酶(辅酶为NAD+)作用下生成磷酸二羟丙酮,磷酸二羟丙酮进入糖酵解途径先同分异构化为3-磷酸甘油醛,3-磷酸甘油醛在其脱氢酶(辅酶为NAD+)作用下生成1,3-二磷酸甘油酸,1,3-二磷酸甘油酸经过一次底物水平磷酸化(生成1个ATP)和3-磷酸甘油酸,3-磷酸甘油酸经变位酶催化变成2-磷酸甘油酸,2-磷酸甘油酸脱水生成磷酸烯醇式丙酮酸,磷酸烯醇式丙酮酸经一次底物水平磷酸化(生成1个ATP)和丙酮酸,以上反应在胞液中进行,丙酮酸进入线粒体,经丙酮酸脱氢酶复合体(有3种酶和6中辅酶组成的符合酶,具体看书,这里脱氢最终给NAD+进入呼吸链生成3*1个ATP)催化生成乙酰COA,
【题目】
乙酰COA进入三羧酸循环(这自己看书,3次脱氢给NAD+进入呼吸链生成3*3个ATP,一次脱氢给FAD+进入呼吸链生成2*1个ATP,一次底物水平磷酸化生成1个ATP)胞液中的2个NAD+可有两种机制(我用的是5版书见155到156页)进入线粒体可能生成4个或6个ATP(这也是为什么1分子葡萄糖彻底氧化会生成36或38ATP的原因)所以最后是20个或22个ATP。 草酰乙酸:
草酰乙酸→PEP→丙酮酸→乙酰辅酶A→进入三羧酸循环彻底氧化分解
-1+1+3+12=15ATP
乳酸:
乳酸→丙酮酸→乙酰辅酶A→进入三羧酸循环彻底氧化分解
3+3+12=18ATP
【题目】
DNA复制是非常复杂的,包含有许多酶和蛋白质因子,请以大肠杆菌为例,列举出8种与复制有关的酶和蛋白质因子,并说明它们呢的功能和复制的哪个阶段发挥作用。(8分)
答:复制的过程和参与酶及因子 复制的过程分四个阶段。第一阶段,亲代DNA分子超螺旋的构象变化及双螺旋的解链,将复制的模板展现出来。第二阶段为复制的引发阶段,有引物RNA进行5′~3′方向的合成。第三阶段为DNA链的延长,在引物RNA合成基础上,进行DNA链的5′~3′方向合成,前导链连续地合成出一条长链,随从链合成出冈崎片段。去除RNA引物后,片段间形成了空隙,DNA聚合酶作用使各个片段靠近。在连接酶作用下,各片段连接成为一条长链。第四阶段为终止阶段,复制叉行进到一定部位就停止前进,最后前导链与随从链分别与各自的模板形成两个子代DNA分子,到此复制过程就完成了。螺旋的松弛与解链 包括超螺旋的构象变化及双螺旋的解链,参与者主要为拓扑异构酶、解链酶及单链结合蛋白等。DNA聚合酶在原核生物中,DNA聚合酶有几种类型。
【题目】
(1)原核生物大肠杆菌DNA聚合酶 1)DNA聚合酶Ⅰ。在随从链合成时,先合成了许多冈崎片段,而后由于RNA引物的去除形成了空隙,此时DNA PolⅠ它催化聚合反应,延长了各个片段,从而填补了片段间的间隙,使以上片段得以靠近,为片段连接成长链创造了条件。所以DNA polⅠ的聚合作用主要是在填补随从链片段间空隙上发挥作用。 DNA PolⅠ还具有3′→5′外切酶活性可识别并去除错误的碱基。这种活性在DNA复制中起了校对功能。DNA PolⅠ的校对活性对DNA复制的准确性起着重要作用。 DNA PolⅠ还具有5′→3′外切酶活性。5′→3′外切酶活性也有修正错误的功能,补充其3′→5′外切酶修正错误的作用。例如紫外照射产生的嘧啶二聚体,就是在其5′→3′切酶作用下切除的。 DNA Pol Ⅲ结构中不对称的二聚体,同时分别催化着前导链和随从链的合成。DNA Pol Ⅲ也具有3′→5′外切酶活性,所以对于DNA复制也有校对的功能,可停止加入或除去错误的核苷酸然后继续加正确的核苷酸。
【题目】
因此,DNA PolⅢ配合DNAPolI可将复制的错误率大大地降低,从10-4降为10-6或更少。 当此片段接近前方的片段时,由DNA Pol Ⅲ的5′→3′外切酶活性切除了RNA引物,造成了片段间的空间;继而DNA PolI催化进行5′→3′方向的聚合作用,填补了片段间的空隙。以下均为蛋白质①Dna A:识别起点序列,在起点特异位置解开双链;②Dna B 解开DNA双链;③Dna C:帮助Dna B结合于双链; ④HU:DNA结合蛋白,促进起始 ⑤引物合成酶 (Dna G):合成RNA引物;⑥单链DNA结合蛋白(SSB):结合单链DNA⑦RNA聚合酶:促进Dna A活性⑧DNA旋转酶(拓扑异构酶②):释放DNA解链过程中产生的扭曲张力⑨Dam 甲基化酶:使起点GATC序列的腺嘌呤甲基化以上均为大肠杆菌起点与复制有关的酶与辅助因子 。
【题目】简述真核生物mRNA的加工过程,以及各种加工过程的生物学意义。(8分)
答:真核生物编码蛋白质的基因以单个基因为转录单位,但有内含子,需切除。信使RNA的原初转录产物是分子量很大的前体,在核内加工时形成大小不等的中间物,称为核内不均一RNA(hnRNA)。其加工过程包括:
1、5’端加帽子:在转录的早期或转录终止前已经形成。首先从5’端脱去一个磷酸,再与GTP生成5’,5’三磷酸相连的键,最后以S-腺苷甲硫氨酸进行甲基化,形成帽子结构。帽子结构有多种,起识别和稳定作用。
2、 3’端加尾:在核内完成。先由RNA酶III在3’端切断,再由多聚腺苷酸聚合酶加尾。尾与通过核膜有关,还可防止核酸外切酶降解。
3、内部甲基化:主要是6-甲基腺嘌呤,在hnRNA中已经存在。可能对前体的加工起识别作用。
【题目】
真核生物编码蛋白质的核基因的内含子属于第二类内含子,左端为GT,右端为AG。先在左端切开,产生的5’末端与3’端上游形成5’,2’-磷酸二酯键,构成套索结构。然后内含子右端切开,两个外显子连接起来。通过不同的拼接方式,可形成不同的信使RNA。
上册:静态化学就是结构化学
下册:动态化学就是代谢过程
养成良好的学习习惯,
以积极乐观的心态去面对。
相信自己,坚持就是胜利。
